Перейти к:
Оценка структуры и функции левого предсердия у больных лимфопролиферативными заболеваниями на фоне проведения полихимиотерапии: одноцентровое наблюдательное исследование
https://doi.org/10.20996/1819-6446-2022-08-02
Аннотация
Цель. Оценить структуру и функцию левого предсердия (ЛП) у пациентов с лимфопролиферативными заболеваниями (ЛПЗ) до проведения полихимиотерапии (ПХТ) и после 3 курсов лечения, а также частоту развития наджелудочковых нарушений ритма (ННР) сердца и уровень маркеров системного воспаления.
Материал и методы. В наблюдательное проспективное исследование включены пациенты с ЛПЗ [n=23; 57% мужчин; медиана возраста 52 (34; 64) лет], ранее не получавших ПХТ. Группа сравнения составили лица без ЛПЗ (n=18; 50% мужчин; медиана возраста 43 (37; 54) лет], сопоставимые с основной группой по полу, возрасту и факторам риска сердечно-сосудистых заболеваний. Всем больным ЛПЗ проведены суточное мониторирование электрокардиограммы, оценка маркеров системы воспаления, проведена стандартная эхокардиография и спекл-трекинг ЛП на момент включения и после 3 курсов ПХТ. Результаты сравнивались с данными группы сравнения.
Результаты. У больных ЛПЗ на момент включения регистрировались сниженные значения параметров деформации ЛП фаз резервуар, кондуит и активного сокращения, каковые были сопоставимы с таковыми в группе сравнения. После проведения 3 курсов ПХТ отмечена тенденция к снижению деформации ЛП фаз кондуит и активного сокращения. У пациентов с ЛПЗ до ПХТ значимо чаще регистрировалась наджелудочковая тахикардия, чем после 3 курсов ПХТ, или у пациентов группы сравнения: 57%, 10% и 33% соответственно. Медиана количества наджелудочковых экстрасистол (НЖЭС) была также выше у пациентов с ЛПЗ до ПХТ [183 (14;841) против 38 (14;94) и 9 (4;38) соответственно]. Не было выявлено ассоциаций между параметрами структурно-функциональных изменений ЛП и частотой развития ННР. Отмечена значимая связь средней силы между СОЭ и НЖЭС (rS=0,44, p<0,05), а также параметрами структурно-функционального состояния ЛП и маркерами системы воспаления: активной фракции выброса (ФВ ЛПакт) и СОЭ (rS=0,42, p<0,05); индексированным объемом ЛП и β-глобулином (rS=0,43, p<0,05); ФВ ЛПакт и нейрегулином-1β (rS=0,55, p<0,05); индексом растяжимости ЛП и нейрегулином-1β (rS=0,55, p<0,05).
Заключение. У больных ЛПЗ регистрировались сниженные параметры деформации ЛП фаз резервуар, кондуит и активного сокращения как до, так и после ПХТ. Установлена связь параметров структурно-функционального состояния ЛП с маркерами системного воспаления, а также ассоциации воспалительных маркеров с частотой ННР.
Ключевые слова
Для цитирования:
Салахеева Е.Ю., Соколова И.Я., Ляпидевская О.В., Жбанов К.A., Цацурова С.А., Каневский Н.И., Стебакова В.О., Привалова Е.В., Ильгисонис И.С., Беленков Ю.Н., Щендрыгина А.А. Оценка структуры и функции левого предсердия у больных лимфопролиферативными заболеваниями на фоне проведения полихимиотерапии: одноцентровое наблюдательное исследование. Рациональная Фармакотерапия в Кардиологии. 2022;18(4):385-392. https://doi.org/10.20996/1819-6446-2022-08-02
For citation:
Salakheeva E.Yu., Sokolova I.Ya., Lyapidevskaya O.V., Zhbanov K.A., Tsatsurova S.A., Kanevskiy N.I., Stebakova V.O., Privalova E.V., Ilgisonis I.S., Belenkov Yu.N., Shchendrygina A.A. Left Atrium Involvement in Lymphoma Patients: Single Center Observational Study. Rational Pharmacotherapy in Cardiology. 2022;18(4):385-392. (In Russ.) https://doi.org/10.20996/1819-6446-2022-08-02
Введение
У пациентов с онкологическими заболеваниями повышен риск развития аритмий сердца [1]. Данные обсервационных исследований свидетельствуют о том, что частота развития наджелудочковых нарушений ритма (ННР) у онкологических больных превышает таковую в общей популяции [2][3]. Так, согласно данным крупного Датского регистра у больных с колоректальным раком фибрилляция предсердий (ФП) развивалась в 2,5-3,5 раза чаще, чем в общей популяции [2]. Аналогичные данные были получены у больных раком молочной железы, у которых риск развития ФП составил 3,4% [3]. Причины данного феномена требуют уточнения.
В течение последних лет особое внимание уделяется структурно-функциональным изменениям миокарда левого предсердия (ЛП). В 2016 г. европейским Обществом Специалистов по Нарушениям ритма был сформулирован консенсус по миопатии ЛП, согласно которому данное состояние определяют как совокупность структурных и функциональных изменений ЛП, а также электрофизиологических нарушений, способных потенциально вызвать значимые клинические проявления [4]. Полагают, что у пациентов с онкологическими заболеваниями миопатия ЛП может иметь место в результате влияния персистирующего субклинического системного воспаления, а также токсического воздействия химиотерапевтических препаратов [5]. Основной и наиболее изученной группой препаратов, обладающих кардиотоксическим действием, являются антрациклиновые антибиотики, которые, наряду с транзиторной дисфункцией кардиомиоцитов, оказывают прямое повреждающие воздействие на клетки миокарда, вызывая необратимые изменения их структуры и функции [6]. Проблема терапии лимфопролиферативных заболеваний (ЛПЗ) обусловлена необходимостью сочетать несколько цитотоксических агентов. Вышеперечисленные факторы могут способствовать повреждению тонкой стенки миокарда ЛП, приводя к его ремоделированию и дисфункции, и, как следствие, к развитию ННР [7]. Структурно-функциональные изменения ЛП у онкологических больных изучены недостаточно.
Цель исследования – изучить структуру и функцию ЛП у пациентов с ЛПЗ до проведения полихимиотерапии и после 3 курсов лечения, а также частоту развития ННР и уровень маркеров системного воспаления.
Материал и методы
Данное проспективное наблюдательное исследование выполнено в соответствии с рекомендациями STROBE (Strengthening the Reporting of Observational Studies in Epidemiology) [8].
В исследование были включены 28 пациентов с ЛПЗ (лимфома Ходжкина, неходжкинские лимфомы). Набор пациентов проводился на базе гематологического отделения Университетской клинической больницы № 1 (Сеченовский Университет) в период с сентября 2020 г. по декабрь 2021 г.
Критерии включения: диагноз ЛПЗ, подтвержденный гистологически и/или в ходе иммунофенотипического / иммуногистохимического, молекулярно-генетического и цитогенетического исследований. Критерии невключения: противоопухолевая терапия в анамнезе, наличие установленного диагноза ишемической болезни сердца (ИБС), хронической сердечной недостаточности, нарушений ритма и проводимости, острое нарушение мозгового кровообращения в течение 3-х мес до начала исследования, хроническая обструктивная болезнь легких 3-4 стадии, тяжелые нарушения функции печени и почек, сахарный диабет 1 типа, аутоиммунные заболевания, иные злокачественные новообразования.
В группу сравнения вошли относительно здоровые добровольцы без ЛПЗ (сотрудники Сеченовского Университета), сопоставимые с основной группой по полу, возрасту, а также факторам риска сердечно-сосудистых заболеваний (курение, дислипидемия, артериальная гипертензия, сахарный диабет, у которых также отсутствовали признаки поражения сердечно-сосудистой системы по данным проведенного обследования.
Всем пациентам с ЛПЗ проводилось суточное мониторирование электрокардиограммы (ЭКГ), эхокардиография с оценкой параметров деформации ЛП при помощи метода 2D спекл-трекинг, а также оценка маркеров воспаления на момент включения (до ПХТ) в исследование и после 3 курсов ПХТ (через 3 мес). Проведено сравнение с данными аналогичного обследования участников группы сравнения на момент включения (рис. 1).
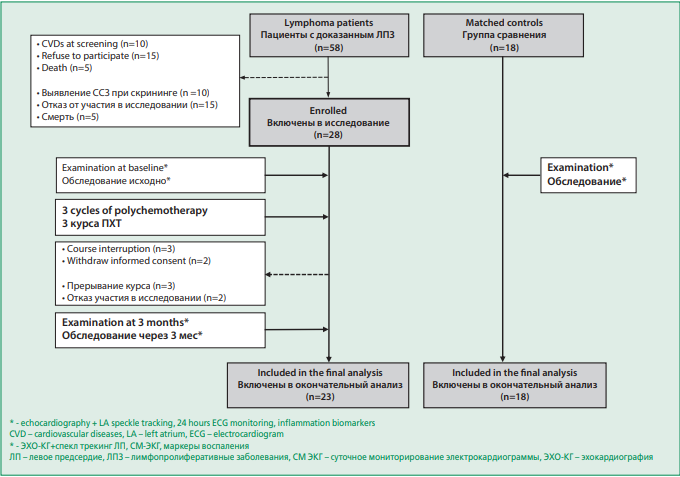
Figure 1. Study design
Рисунок 1. Дизайн исследования
Исследование выполнялось в соответствии с принципами Хельсинкской декларации. Пациенты были включены в исследования после подписания Информированного согласия. Протокол исследования одобрен локальным этическим комитетом Сеченовского Университета.
Клиническо-лабораторные данные. Демографические и клинические параметры включали пол, возраст, вес, рост, индекс массы тела, факторы риска сердечно-сосудистых заболеваний (ССЗ) и регистрировались в индивидуальной электронной карте больного в системе RedCAP. У пациентов с ЛПЗ учитывался тип лимфомы (лимфома Ходжкина, неходжкинские лимфомы), а также индивидуальная кумулятивная доза доксорубицина после проведения 3-х курсов полихимиотерапии (ПХТ). Проводилась оценка маркеров системы воспаления: скорость оседания эритроцитов (СОЭ), С-реактивный белок (СРБ), ферритин, α1-глобулин, α2-глобулин, β-глобулин, γ-глобулин, фибриноген), нейрегулина-1β (Duoset ELISA (R&D Systems®, США). Регистрировалась терапия ССЗ.
Эхокардиографическое исследование. Эхокардиография проводилась на аппарате Aplio 500 (Toshiba, Япония) в соответствии с российскими рекомендациями и рекомендациями американского общества по эхокардиографии [9] сертифицированным специалистом, который не был ознакомлен с клиническими данными пациента. Оцениваемые ЭХО-КГ параметры включали параметры площади и объемов обоих предсердий, объемов и массы левого желудочка (ЛЖ). Все объемные параметры были индексированы на площадь поверхности тела. Фракция выброса ЛЖ определялась по методу Симпсона. Диастолическая функция ЛЖ оценивалась с использованием методов пульсовой и тканевой допплерографии с определением параметра E/е’. Изучалось состояние клапанного аппарата сердца.
Фазовая оценка структуры и функции левого предсердия. Фаза резервуара, или фаза наполнения, которая характеризует растяжимость ЛП, определялась в период систолы ЛЖ при закрытых створках митрального клапана, в конце зубца Т на ЭКГ. В период фазы резервуар оценивались максимальный индексированный объем ЛП (ИОЛПmax), индекс растяжимости ЛП (ИР ЛП). Общая фракция выброса ЛП (ФВ ЛП) определялась по формуле:
ФВ ЛП=(ОЛПmax – ОЛПmin)/ОЛПmax, где ОЛПmax – максимальный объем ЛП, ОЛПmin – минимальный объем ЛП.
ИР ЛП рассчитывался по формуле:
ИР ЛП=(ОЛПmax – ОЛПmin)/ОЛПmin, где ОЛПmax – максимальный объем ЛП, ОЛПmin – минимальный объем ЛП.
Фаза кондуит изучалась во время ранней диастолы. В данную фазу также определялись объем ЛП (ИОЛПк) и пассивная ФВ ЛП (ФВ ЛПпас) по формуле:
ФВ ЛПпас=(ОЛПmax – ОЛПpre)/ОЛПmax, где ОЛПmax – максимальный объем ЛП, ОЛПpre – объем ЛП перед его сокращением.
Фаза активного сокращения ЛП, которая характеризует сократительную способность миокарда ЛП, оценивалась во время поздней диастолы при активном сокращении миокарда ЛП. В данную фазу рассчитывали минимальный индексированный объем ЛП (ИОЛПmin), активную ФВ ЛП (ФВ ЛПакт):
ФВ ЛПакт=(ОЛПpre – ОЛПmin)/ОЛПpre, где ОЛПpre – объем ЛП перед его сокращением, ОЛПmin – минимальный объем ЛП [10].
Стрейн-эхокардиография левого предсердия. Деформация ЛП определялась с использованием 2- или 4-камерной позиций, и рассчитывалась как среднее значение 6 сегментов этих двух позиций [11]. Деформация фаз резервуар, кондуит и активного сокращения определялась на основании полученной монофазной кривой деформации ЛП, где первый и второй пики соответствовали фазам резервуар и активного сокращения, а разница между ними соответствовала фазе кондуит. За нормальные значения деформации ЛП принимались: для фазы резервуар – значения >39%, для фазы кондуит – >23%, для фазы активного сокращения значение параметра – >17% [11].
Статистический анализ. Количественные данные представлены в виде медианы (Me) и межквартильного диапазона (25%; 75%). Качественные данные представлены в виде абсолютных (n) и относительных значений (%). Различия между группами определялись с использованием критерия хи-квадрат или U-критерия Манна-Уитни. Для оценки различий связанных групп использовался критерий Вилкоксона. Различия считали статистически значимыми при р<0,05. Корреляционный анализ проводился с помощью коэффициента корреляции Пирсона. Статистическая обработка данных проводилась с использованием пакета статистических программ Statistica 10.0 (Statsoft Inc., США).
Результаты
Характеристика обследуемых лиц. Основная группа и группа сравнения были сопоставимы по полу, возрасту и факторам риска ССЗ (табл. 1). 23 пациента прошли 3 курса ПХТ. Медиана кумулятивной дозы доксорубицина составила 300 (285; 360) мг. На момент включения 26% больных получали ингибиторы ангиотензинпревращающего фермента (ИАПФ)/блокаторы рецепторов к ангиотензину (БРА) и 26% – бета-адреноблокаторы (ББ). После завершения 3 курсов ПХТ доля пациентов, принимающих ИАПФ/БРА и ББ, несколько выросла и составила 43% и 39% соответственно (p>0,05).
Фазовый анализ структуры и функции левого предсердия. У больных ЛПЗ отмечалось снижение деформации ЛП фаз резервуар, кондуит и активного сокращения как до проведения ПХТ, так и после проведения 3 курсов противоопухолевой терапии (табл. 2). Несмотря на тенденцию к снижению всех параметров деформации ЛП на фоне 3 курсов ПХТ, значимых различий параметров между группами исходно и через 3 мес отмечено не было. Также эти параметры были сопоставимы с таковыми в группе сравнения. ИОЛПmax, ИОЛПmin и ИОЛПк, общая ФВ ЛП, ФВ ЛПпас и ФВ ЛПакт не различались между группой больных ЛПЗ и группой сравнения (табл. 2). Не было выявлено ассоциации параметров структурно-функционального состояния ЛП с параметрами, характеризующими систолическую и диастолическую (E/e’) функции ЛЖ. При этом у больных ЛПЗ E/e’ был значимо выше при сопоставлении с группой сравнения, хотя значения данного параметра находились в пределах нормальных значений (см. табл. 1).
Наджелудочковые нарушения ритма. Среднесуточная частота сердечных сокращений была сопоставима во всех группах (табл. 3). Наджелудочковая тахикардия (НЖТ) значимо чаще регистрировалась у больных ЛПЗ до ПХТ, чем после проведения 3 курсов ПХТ или у пациентов группы сравнения: 57%, 10% и 33% соответственно. Среднее количество наджелудочковых экстрасистол также было выше у больных ЛПЗ на момент включения. За период наблюдения не было зарегистрировано эпизодов фибрилляции и трепетания предсердий в группе больных ЛПЗ. В ходе анализа подгрупп, сформированных по принципу наличия НЖТ не было выявлено значимых различий параметров структурно-функционального состояния ЛП. В подгруппе пациентов, получающих ББ, деформация ЛП в фазу активного сокращения была значимо выше, чем у тех, кто данную терапию не получал.
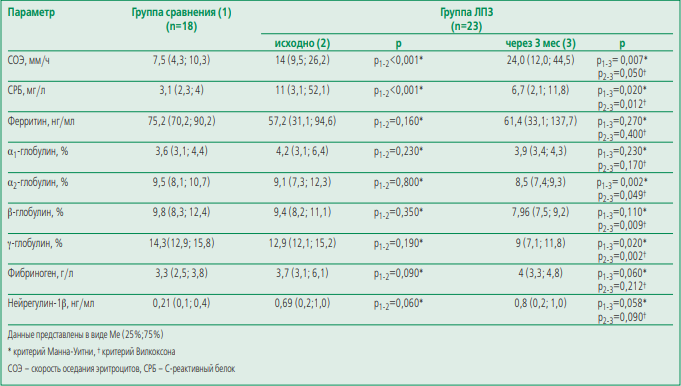
Биомаркеры системного воспалительного ответа и нейрегулин-1. В группе больных ЛПЗ на момент включения СОЭ, концентрация СРБ и нейрегулина-1 были значимо выше, чем в группе сравнения. На фоне проведения ПХТ уровни СРБ, α2-, β- и γ-глобулинов значимо снизились, при этом уровень СОЭ значимо увеличился (табл. 4).
Анализ связи параметров структуры и функции левого предсердия с биомаркерами системного воспаления и наджелудочковыми нарушениями ритма. Параметры структурно-функционального состояния ЛП значимо ассоциировались с маркерами воспаления (ФВ ЛПакт и СОЭ: rS=0,42, p<0,05; ИОЛП и β-глобулин: rS=0,43, p<0,05; ФВ ЛПакт и фибриноген: rS=-0,41, p<0,05) и нейрегулином-1 β (ФВ ЛПакт: r2=0,55 p<0,05; ИР ЛП: rS=0,55, p<0,05; общая ФВ ЛП: rS=0,55, p<0,05). Отмечена значимая связь средней силы между СОЭ и количеством наджелудочковых экстрасистол: rS=0,44, p<0,05). Не отмечено корреляции между параметрами структурно функциональных изменений ЛП и частотой развития наджелудочковых нарушений ритма.
Table 1. Baseline patient characteristics
Таблица 1. Характеристика обследуемых больных
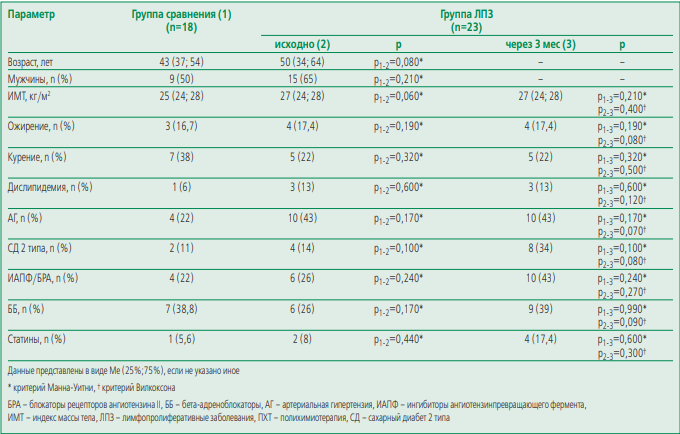
Table 2. Parameters of the structure and function of the left atrium
Таблица 2. Параметры структуры и функции ЛП
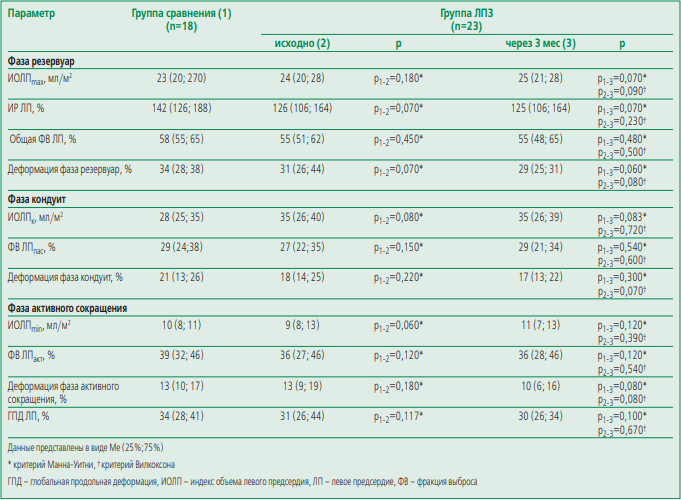
Table 3. Parameters of 24-hours ECG monitoring
Таблица 3. Параметры суточного мониторирования ЭКГ
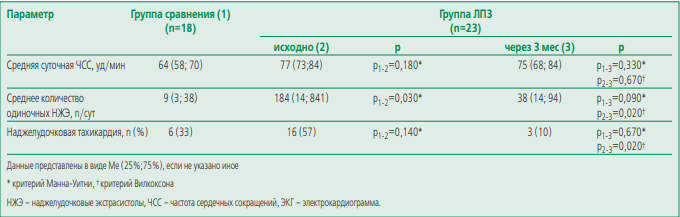
Table 4. Inflammatory biomarkers
Таблица 4. Маркеры системного воспаления
Обсуждение
В данном проспективном наблюдательном исследовании больных с ЛПЗ регистрировались сниженные значения параметров деформации ЛП фаз резервуар, кондуит и активного сокращения до ПХТ. Отмечена тенденция к снижению деформации фазы кондуит и активного сокращения после ПХТ. Исходно у больных ЛПЗ значимо чаще регистрировались ННР. Корреляции между параметрами структурно-функциональных изменений ЛП и частотой развития ННР отмечено не было. Уровень маркеров системного воспаления значимо ассоциировался с более высокой частотой ННР, а также параметрами структурно- функционального состояния ЛП.
Ранее было установлено, что ННР являются частым кардиальным осложнением у онкологических больных [12][13]. Причины развития ННР у данной категории пациентов до конца не ясны. Обсуждается роль миопатии ЛП, которая может развиваться в результате повреждающего воздействия ПХТ и влияния субклинического системного воспаления [14]. Деформация ЛП является чувствительным маркером повреждения миокарда, который позволяет выявить субклинические изменения ЛП на ранних этапах [15]. Однако работ, посвященных оценке фазовых параметров деформации ЛП у больных онкологического профиля недостаточно.
Tadic M. и соавт. ретроспективно провели фазовый анализ деформации и объемных показателей ЛП у 92 пациентов с различными онкологическими заболеваниями, которые ранее не получали противоопухолевую терапию [16]. Авторы выявили снижение функции ЛП фаз резервуар и кондуит и установили, что наличие онкологического заболевания является независимым предиктором данных изменений. В нашем исследовании у больных ЛПЗ до ПХТ также отмечено снижение параметров деформации ЛП фаз резервуар, кондуит и активного сокращения, как до ПХТ, так и поле 3 курсов ПХТ. При этом данные характеристики не отличались от таковых при соотнесении с группой сравнения, сопоставимой по факторам риска ССЗ, что не позволяет исключить возможное влияние факторов риска ССЗ на данные параметры.
В нашем исследовании также отмечена тенденция к снижению деформации ЛП фазы кондуит и активного сокращения после проведения 3 курсов ПХТ. Ранее в перспективном наблюдательном исследовании M. Laufer-Perl и соавт., в котором оценка фазовой деформации ЛП была проведена 40 пациентам с раком молочной железы до и после 3 курсов ПХТ, авторы выявили снижение стрейна ЛП фаз резервуар и кондуит на фоне лечения [17]. Возможно, отсутствие значимости различий параметров стрейна ЛП до и после ПХТ могут быть обусловлены относительно небольшим размером выборки, а также влиянием кардиопротективной терапии. Так, в исследовании M. Laufer-Perl только 7% получали терапию ББ, а в нашем исследовании доля таких больных на момент включения составила 21% и несколько увеличилась за период наблюдения до 39% (p=0,09). Важно отметить, что ходе анализа подгрупп не отмечалось значимых различий параметров деформации фаз резервуар и кондуит в зависимости от терапии ББ.
Важно подчеркнуть, что ранее связь между параметрами структурно-функционального состояния ЛП с ННР, а также маркерами системного воспаления не изучалась. В нашем исследовании такой анализ был проведен впервые. Обращало на себя внимание наличие значимой связи между маркерами системного воспаления и параметрами ремоделирования и дисфункции ЛП (СОЭ и ФВ ЛПакт; фибриноген и ФВ ЛПакт; ИОЛП и β-глобулин). Полученные результаты подтверждает гипотезу о возможном влиянии воспаления на миокард ЛП у больных онкологического профиля, но данное предположение требует проведения дальнейших исследований.
Интересными представляются и полученные результаты о связи маркеров СОЭ и частотой ННР. В ранее выполненных исследованиях у больных с ФП неоднократно было показано, что СОЭ выступает предиктором развития данного нарушения ритма [18]. Установлено, что степень выраженности системного воспалительного ответа связана с более высоким риском развития ФП и прямо коррелирует со структурнофункциональными изменениями предсердий [19]. Предположение о связи воспаления с ФП также подтверждает тот факт, что противовоспалительная терапия колхицином применяется у пациентов в периоперационном периоде при радиочастотной абляции для профилактики развития ФП [20]. Стоит отметить, что мы не наблюдали ассоциации ННР и структурно-функциональных изменений ЛП. Трактовка данных результатов требует дальнейших исследований с включением большего числа пациентов.
Таким образом, в исследовании выполнена проспективная оценка структурно-функциональных изменений ЛП, ННР и маркеров системы воспаления в динамике до и после проведения ПХТ в достаточно однородной группе больных ЛПЗ, что позволяет не только судить о развитии ранних изменений миокарда ЛП, но и соотнести эти изменения с клинически значимыми параметрами.
Ограничения исследования. Ограничениями данной работы является относительно небольшой размер выборки, что ограничивает возможности проведения дополнительного анализа взаимосвязи выявленных изменений и оценки влияния кардиопротективной терапии.
Заключение
Проведенное исследование позволило оценить изменение параметров структурно-функционального состояния ЛП у больных ЛПЗ на фоне ПХТ. Выявлены снижение параметров деформации ЛП, корреляции показателей структурно функционального состояния ЛП с маркерами системного воспаления, а также ассоциации воспалительных маркеров с частотой ННР.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта №18-515-76002, научного гранта «Роль Нейрегулина-1 в развитии и прогрессировании сердечнососудистой патологии: выявление агониста ErbB4 рецептора и приоритетных групп терапии».
Financing. The study was performed with the financial support of the Russian Foundation for Basic Research within the framework of scientific project №18-515- 76002, scientific grant “The neuregulin-1 pathway in development and progression cardiovascular disease: identification of small molecule ErbB4 agonists and identification of patient populations that could benefit the most”.
Список литературы
1. Васюк Ю.А., Гендлин Г.Е., Емелина Е.И., и др. Согласованное мнение Российских экспертов по профилактике, диагностике и лечению сердечно-сосудистой токсичности противоопухолевой терапии. Российский Кардиологический Журнал. 2021;26(9):4703. DOI:10.15829/1560-4071-2021-4703.
2. Erichsen R, Christiansen CF, Mehnert F, et al. Colorectal cancer and risk of atrial fibrillation and flutter: a population-based case-control study. Intern Emerg Med. 2012;7(5):431-8. DOI:10.1007/s11739-011-0701-9.
3. Saliba W, Rennert HS, Gronich N, et al. Association of atrial fibrillation and cancer: Analysis from two large population-based case-control studies. PLoS ONE. 2018;13(1):e0190324. DOI:10.1371/journal. pone.0190324.
4. Goette A, Kahan JM, Aguinaga L, et al. EHRA/HRS/APHRS/SOLAECE expert consensus on atrial cardiomyopathies: definition, characterization, and clinical irnplication. Ep Europace. 2016;18(10):1455-90. DOI:10.1093/europace/euw161.
5. Wang L, Wang F, Chen L, et al. Long-term cardiovascular disease mortality among 160 834 5-year survivors of adolescent and young adult cancer: an American population-based cohort study. Eur Heart J. 2021;42(1):101-9. DOI:10.1093/eurheartj/ehaa779.
6. Ewer MS, Lipprnnan SM. Type II chemotherapy-related cardiac dysfunction: trne to recognize a new entity. J Clin Oncol. 2005;23(13):2900-2. DOI:10.1200/JCO.2005.05.827.
7. Packer M. Epicardial Adipose Tissue May Mediate Deleterious Effects of Obesity and Inflammation on the Myocardium. J Am Coll Cardiol. 2018;71(20):2360-72. DOI:10.1016/j.jacc.2018.03.509.
8. Cuschieri S. The STROBE guidelines. Saudi J Anaesth. 2019;13(Suppl 1):S31-S34. DOI:10.4103/sja.SJA_543_18.
9. Lang RM, Badano PL, Luigi P, et al. Recommendations for Cardiac Chamber Quantification by Echocardiography in Adults: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2015;16(3):233-71. DOI:10.1093/ehjci/jev014.
10. Павлюкова Е.Н., Кужель Д.А., Матюшин Г.В. Функция левого предсердия: современные методы оценки и клиническое значение. Рациональная Фармакотерапия в Кардиологии. 2017;13(5):675-83. DOI:10.20996/1819-6446-2017-13-5-675-683.
11. Pathan F, D'Elia N, Nolan MT, et al. Nornal Ranges of Left Atrial Strain by Speckle-Tracking Echocardiography: A Systernatic Review and Meta-Analysis. J Am Soc Echocardiogr 2017;30(1):59-70. DOI:10.1016/j.echo.2016.09.007.12.
12. Guha A, Fradley MG, Dent SF, et al. Incidence, risk factors, and mortality of atrial fibrillation in breast cancer: a SEER-Medicare analysis. Eur Heart J. 2022;43(4):300-12. DOI:10.1093/eurheartj/ehab745.
13. Lopez-Fernandez T, Martin-Garcia A, Roldan Rabadan I, et al. Atrial Fibrillation in Active Cancer Patients: Expert Position Paper and Recommendations. Rev Esp Cardiol (Engl Ed). 2019;72(9):749-59. DOI:10.1016/j.rec.2019.03.019.
14. Chu G, Versteeg HH, Verschoor AJ, et al. Atrial fibrillation and cancer - An unexplored field in cardiovascular oncology. Blood Rev. 2019;35:59-67.DOI:10.1016/j.blre.2019.03.005.
15. Inciardi RM, Rossi A. Left atriurn: a forgotten biornarker and a potential target in cardiovascular rnedicine. J Cardiovasc Med (Hagerstown). 2019;20(12):797-808. DOI: 10.2459/JCM.0000000000000886.
16. Tadic M, Genger M, Cuspidi C, et al. Phasic Left Atrial Function in Cancer Patients Before Initiation of Anti-Cancer Therapy. J Clin Med. 2019;8(4):421. DOI:10.3390/jcrn8040421.
17. Laufer-Perl M, Arias O, Dortaan SS, et al. Left Atrial Strain changes in patients with breast cancer during anthracycline therapy. Int J Cardiol. 2021;330:238-44. DOI:10.1016/j.ijcard.2021.02.013.
18. Aviles RJ, Martin DO, Apperson-Hansen C, Houghtaling PL, et al. Inflammation as a risk factor for atrial fibrillation. Circulation. 2003;108(24):3006-10. DOI:10.1161/01.CIR.0000103131.70301.4F.
19. Zhang H, Li J, Chen X, et al. Association of Systernic Inflammation Score With Atrial Fibrillation: A Case-Control Study With Propensity Score Matching. Heart Lung Circ. 2018;27(4):489-96. DOI:10.1016/j.hlc.2017.04.007.
20. Lee J, Singh N, Howe C, et al. Colchicine for Prevention of Post-Operative Atrial Fibrillation: A MetaAnalysis. JACC Clinical Electrophysiology. 2016;2(1):78-85. DOI:10.1016/j.jacep.2015.09.016.
Об авторах
Е. Ю. СалахееваРоссия
Салахеева Екатерина Юрьевна.
Москва.
И. Я. Соколова
Россия
Соколова Ирина Яковлевна.
Москва.
О. В. Ляпидевская
Россия
Ляпидевская Ольга Владимировна.
Москва.
К. A. Жбанов
Россия
Жбанов Константин Александрович.
Москва.
С. А. Цацурова
Россия
Цацурова Сабрина Александровна.
Москва.
Н. И. Каневский
Россия
Каневский Николай Игоревич.
Москва.
В. О. Стебакова
Россия
Стебакова Вера Олеговна.
Москва.
Е. В. Привалова
Россия
Привалова Елена Витальевна.
Москва.
И. С. Ильгисонис
Россия
Ильгисонис Ирина Сергеевна.
Москва.
Ю. Н. Беленков
Россия
Беленков Юрий Никитич.
Москва.
А. А. Щендрыгина
Россия
Щендрыгина Анастасия Александровна.
Москва.
Рецензия
Для цитирования:
Салахеева Е.Ю., Соколова И.Я., Ляпидевская О.В., Жбанов К.A., Цацурова С.А., Каневский Н.И., Стебакова В.О., Привалова Е.В., Ильгисонис И.С., Беленков Ю.Н., Щендрыгина А.А. Оценка структуры и функции левого предсердия у больных лимфопролиферативными заболеваниями на фоне проведения полихимиотерапии: одноцентровое наблюдательное исследование. Рациональная Фармакотерапия в Кардиологии. 2022;18(4):385-392. https://doi.org/10.20996/1819-6446-2022-08-02
For citation:
Salakheeva E.Yu., Sokolova I.Ya., Lyapidevskaya O.V., Zhbanov K.A., Tsatsurova S.A., Kanevskiy N.I., Stebakova V.O., Privalova E.V., Ilgisonis I.S., Belenkov Yu.N., Shchendrygina A.A. Left Atrium Involvement in Lymphoma Patients: Single Center Observational Study. Rational Pharmacotherapy in Cardiology. 2022;18(4):385-392. (In Russ.) https://doi.org/10.20996/1819-6446-2022-08-02

















































