Перейти к:
Сила дыхательных мышц у пациентов с ишемической болезнью сердца и различными вариантами нарушения костно-мышечной функции
https://doi.org/10.20996/1819-6446-2022-08-04
Аннотация
Цель. Оценить силу дыхательных мышц у больных с ишемической болезнью сердца (ИБС) с различными вариантами нарушения костномышечной функции.
Материалы и методы. С учетом нарушений костно-мышечного статуса (КМС) сформированы четыре группы. В I группу вошли 52 (13,4%) пациента с изолированной саркопенией, во II группу - 28 (7,2%) больных изолированной остеопенией, в III группу - 25 (6,5%) пациентов с остеосаркопенией, IV группу составили лица без нарушений КМС - 282 (72,9%). Всем участникам выполнено исследование силы дыхательных мышц с анализом максимальных экспираторного (MEP) и инспираторного (MIP) давлений в полости рта.
Результаты. Медиана силы дыхательных мышц была ниже нормативных значений, причем, сила экспираторных мышц ниже в 1,25 раза в сравнении с инспираторными. В пределах нормы оба параметра отмечены у 191 (49,3%) больного, у 196 (50,7%) верифицированы различные варианты снижения. Изолированное снижение MIP наблюдалось у 24,8% пациентов, изолированное снижение МЕР - у 6,5%, сочетанное снижение MIP и МЕР - у 19,4%. Сравнительный анализ МЕР и MIP в зависимости от варианта нарушения КМС не продемонстрировал статистически значимых различий. Наибольшая доля лиц со сниженным MEP (76,9%) и MIP (75%) отмечена в группе с изолированной саркопенией. Аналогичная закономерность определена для пациентов с остеосаркопенией и лиц без нарушений костно-мышечного статуса. Нормативные значения силы дыхательных мышц зарегистрированы у больных остеопенией. По результатам корреляционного анализа выявлена однонаправленная связь силы дыхательных мышц с параметрами, характеризующими мышечную функцию (сила сжатия кисти, площадь мышц и скелетно-мышечный индекс) и разнонаправленную связь МЕР и индекса массы тела (г -0,743, р=0,013), MIP и возраста пациента (r -0,624, р=0,021).
Заключение. У половины пациентов с ИБС диагностирована клинически значимая слабость дыхательных мышц. Не выявлено статистически значимых различий по силе дыхательных мышц между больными с нарушением КМС и изолированной ИБС, несмотря на более низкие параметры в группе с нарушениями КМС. Корреляционный анализ продемонстрировал закономерную связь силы дыхательных мышц с параметрами, характеризующими мышечную функцию.
Ключевые слова
Для цитирования:
Баздырев Е.Д., Терентьева Н.А., Галимова Н.А., Кривошапова К.Е., Барбараш О.Л. Сила дыхательных мышц у пациентов с ишемической болезнью сердца и различными вариантами нарушения костно-мышечной функции. Рациональная Фармакотерапия в Кардиологии. 2022;18(4):393-401. https://doi.org/10.20996/1819-6446-2022-08-04
For citation:
Bazdyrev E.D., Terentyeva N.A., Galimova N.A., Krivoshapova K.E., Barbarash O.L. Respiratory Muscle Strength in Patients with Coronary Heart Disease and Different Musculoskeletal Disorders. Rational Pharmacotherapy in Cardiology. 2022;18(4):393-401. https://doi.org/10.20996/1819-6446-2022-08-04
Введение
Старение – многофакторный биологический процесс, ассоциированный со снижением физиологических функций организма, обусловленных, прежде всего, накоплением клеточных повреждений и приводящий к хроническим заболеваниям, повышенной восприимчивости к осложнениям и, как следствие, к инвалидизации и смерти [1]. В настоящее время не вызывает сомнений, что возраст служит немодифицируемым фактором риска развития онкопатологии, сердечнососудистых заболеваний, возраст-ассоциированной слабости, метаболической дисфункции, саркопении, остеоартрита и остеопороза, а также множества других хронических заболеваний [2]. Поскольку пожилые люди представляют наиболее быстрорастущий сегмент населения в большинстве развитых стран, возрастает необходимость проведения научных исследований среди данной когорты.
Закономерно процесс старения сопровождается рядом изменений в организме, в том числе, в костномышечной системе. Так, при достижении шестого десятилетия жизни у пожилого человека наблюдается постепенное снижение минеральной плотности костной ткани (от 1 до 1,5% в год), мышечной массы (около 1% в год) и силы (2,5-3% в год), что предрасполагает к риску развития таких возраст-ассоциированных состояний, как остеопенический синдром, саркопения и остеосаркопения [3]. Поскольку саркопения является генерализованным процессом, считается, что она затрагивает не только системную скелетную мускулатуру, но и дыхательные мышцы [4].
Состояние атрофии и слабости мышечных волокон, возникающее в дыхательных мышцах наряду с системной скелетной мускулатурой при старении, известно как респираторная саркопения [5-7]. Респираторная саркопения вызывает снижение дыхательной силы [8] и легочной функции [9], что может негативно влиять на повседневную активность и качество жизни [8,9]. Кроме этого, снижение силы дыхательных мышц может привести к неблагоприятным клиническим исходам. Так, снижение силы и массы дыхательной мускулатуры может привести к нарушению вентиляции и, как следствие, ухудшению оксигенации и развитию полиорганной дисфункции вследствие гипоксии. Широко распространено мнение, что нарушение вентиляции может быть ассоциировано и с более высоким риском сердечно-сосудистых заболеваний из-за снижения переносимости физической нагрузки и повышенного окислительного стресса [4].
Исследования, направленные на оценку мышечной функции, в том числе, респираторных мышц, прежде всего актуальны для пациентов, подвергающихся коронарному шунтированию (КШ) – одному из эффективных хирургических методов лечения ишемической болезни сердца (ИБС). Кардиохирургические вмешательства часто ассоциированы с послеоперационной респираторной дисфункцией, следствием которой выступают гиповентиляция, неэффективный кашель и гипоксемия, что приводит к риску послеоперационных легочных осложнений, таких как ателектаз, бронхоспазм, пневмония, дыхательная недостаточность, острый респираторный дистресс-синдром, продленная искусственная вентиляция легких, дисфункция диафрагмы и плевральные эксфузии [10][11]. Дисфункция дыхательных мышц при операциях на сердце – следствие множества факторов [12]. Использование трансплантатов (особенно, трансплантата внутренней грудной артерии) приводит к уменьшению кровоснабжения межреберных мышц, стернотомия – к болевому синдрому и изменению механики грудной клетки; седация, применение миелорелаксантов и боль способствуют поверхностному дыханию и гиповентиляции; искусственное кровообращение и местное охлаждение с целью защиты миокарда могут вызвать повреждение диафрагмального нерва; плевральные дренажи (особенно, межреберный) еще больше снижают легочную функцию [12].
Бесспорно, реабилитация – основной метод, который помогает управлять данными рисками и значительно улучшает прогноз [13,14]. Согласно национальным рекомендациям по реабилитации больных после КШ особое внимание следует уделять не только кардиореабилитации, но и преабилитации, включающей общую физическую нагрузку, тренировку дыхательной мускулатуры, обучение методики диафрагмального дыхания и др. [15]. Физические упражнения – одни из ключевых компонентов кардиореабилитации, поскольку улучшают кровообращение и повышают окислительную способность мышц в дополнение к множеству других преимуществ. С течением времени меняется портрет пациента, поступающего для хирургического лечения сердечно-сосудистых патологий: увеличиваются тяжесть атеросклеротического поражения коронарных артерий, выраженность коморбидного фона, а также возраст больных [16].
Таким образом, актуальным становится не только изучение влияния возраст-ассоциированных заболеваний и синдромов на исходы кардиохирургических вмешательств, но и разработка методик реабилитационного воздействия на данную категорию пациентов с учетом возрастных особенностей костномышечной функции. В ФГБНУ «Научно-исследовательский институт комплексных проблем сердечнососудистых заболеваний» (НИИ КПССЗ) ведется научный проект по исследованию патофизиологических особенностей нарушения костно-мышечно-жирового и сердечно-сосудистого ремоделирования как маркеров патологического старения. Основная гипотеза заключается в том, что сердечно-сосудистая патология может быть ответственна за более раннее патологическое старение. В рамках настоящей публикации представлены результаты исследования, цель которого – оценить силу дыхательных мышц у пациентов с ИБС и различными вариантами нарушения костномышечной функции.
Материал и методы
В исследование последовательно включены 387 больных стабильной формой ИБС, поступивших в НИИ КПССЗ (Кемерово) с 2019 по 2020 гг. для выполнения планового КШ. В исследование вошли лица, соответствующие критериям включения/невключения.
Критерии включения: 1) стабильная ИБС; 2) плановое коронарное шунтирование в условиях искусственного кровообращения; 3) согласие на участие в исследовании.
Критерии невключения: 1) нервно-мышечные заболевания; 2) деформация грудной клетки и позвоночника (сколиотическая болезнь, лордоз); 3) прием ряда лекарственных средств (глюкокортикостероиды, антидепрессанты, барбитураты, миорелаксанты); 4) оперативное вмешательство на органах грудной клетки в анамнезе; 5) неспособность понять и/или выполнить процедуры протокола исследования; 6) отказ (отзыв согласия) от участия в исследовании.
Исследование одобрено локальным этическим комитетом НИИ КПССЗ (протокол № 12 от 27.12.2019). Перед включением в исследование все участники подписали форму информированного согласия.
Верификация саркопении осуществлена в соответствии с критериями EWGSOP (2019 г.) на основе анализа опросника SARC-F, определения силы сжатия кисти и количественной оценки скелетных мышц с учетом полученных значений площади мышечной ткани и расчетного скелетно-мышечного индекса при выполнении мультиспиральной компьютерной томографии [17]. Остеопенический синдром (остеопения/ остеопороз) диагностирован на основании критериев Всемирной организации здравоохранения (2008 г.) для женщин в постменопаузе, по Т-критерию, полученному при двухэнергетической рентгеновской абсорбциометрии – у мужчин старше 50 лет [18]. При сочетании у одного пациента саркопении с остеопеническим синдромом диагностировали остеосаркопению [19].
В соответствии с вышеуказанными критериями сформированы четыре группы. Первую группу составили 52 (13,4%) пациента с изолированной саркопенией, вторую – 28 (7,2%) больных с изолированным остеопеническим синдромом (остеопения/остеопороз), в третью вошли 25 (6,5%) пациентов с остеосаркопенией, четвертую группу составили 282 (72,9%) участника с ИБС без нарушений костно-мышечной функции. Исследование силы дыхательных мышц осуществляли за три дня до выполнения КШ на бодиплетизмографе Elite Dl-220v (Medical Graphics Corporation, США) с использованием программного обеспечения Breeze Suite 6.2 в соответствии с критериями Американского торакального и Европейского респираторного обществ (ATS/ERS) [20]. В основе метода оценки силы дыхательных мышц лежит измерение максимальных статичных давлений на уровне рта, которые пациент создает при закрытых дыхательных путях во время максимальных вдоха и выдоха с последующим анализом максимальных экспираторного (maximal expiratory pressure, MEP) и инспираторного (maximal inspiratory pressure, MIP) давлений в полости рта. Посредством измерения MIP в первую очередь оценивают силу диафрагмы, с помощью MEP – преимущественно межреберные мышцы и мышцы брюшной стенки [21].
При измерении MIP и MEP выполняли 5-6 маневров (не менее 3) для определения каждого параметра, с временным интервалом между маневрами не менее одной минуты. Исследование прекращали после достижения различий между тремя максимальными значениями менее 20%, а в итоговый протокол включали максимальное значение параметра. Если максимальный результат получен при выполнении последней попытки, его не учитывали.
Измерения проводили в положении сидя. Для предотвращения утечки воздуха использовали носовой зажим, а для обеспечения минимальной утечки воздуха из ротовой полости при выполнении маневров – фланцевый мундштук. При проведении экспираторного маневра было рекомендовано поддерживать щеки больного для уменьшения вклада сокращения щечных мышц. Больные должны были сделать максимальный вдох для определения MIP и выдох с последующей оценкой MEP при закрытом мундштуке. Пациент выполнял маневр MIP от уровня остаточного объема легких (после полного выдоха), маневр MEP – от уровня общей емкости легких (после полного вдоха). Длительность каждого маневра во время теста оценки дыхательной мускулатуры составляла не менее 1,5 с.
Учитывая отсутствие единого подхода к интерпретации силы дыхательных мышц, в данном исследовании MIP и MEP оценивали с позиции уровня нижней границы нормы (low level of normal, LLN). LLN для MIP и MEP рассчитаны с помощью эталонных уравнений, предложенных J.A. Evans и W.A. Whitelaw [22] (табл. 1). MIP и MEP считали ниже нормативных значений, если данные параметры были ниже LLN.
Table 1. Calculation equations for determining the lower limit of the MIP and MEP norm
Таблица 1. Расчетные уравнения для определения нижней границы нормы MIP и MEP
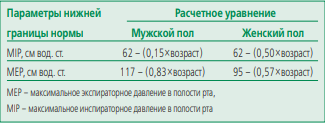
Согласно рекомендациям ATS/ERS [20][23], MIP 80 см вод.ст. свидетельствует об отсутствии клинически значимой слабости дыхательных мышц.
Статистический анализ данных проводили с использованием пакета прикладных программ Statistica 6.1 (StatSoft Inc., США). Характер распределения данных оценивали с помощью критерия Шапиро-Уилка. Распределение всех количественных данных отличалось от нормального. Качественные показатели представлены в виде частот (n, %), количественные – центральными тенденциями и рассеянием: медианой (Me) и интерквартильным размахом (25%; 75%). Сравнение трех и более независимых групп проводили с помощью рангового анализа вариаций по Краскелу-Уоллису. Для оценки различий относительных величин использовали анализ таблиц сопряженности 2×2. Проверку гипотез проводили по критерию χ² (Пирсона). При малом числе наблюдений применяли двусторонний точный критерий Фишера с поправкой Йейтса. Для анализа связей между признаками использовали коэффициент ранговой корреляции Спирмена. Различия средних и корреляционные связи считали статистически значимыми при p≤0,05.
Результаты
Клинико-анамнестическая характеристика больных с различными вариантами нарушения костно-мышечной функции представлена в табл. 2.
Table 2. Comparative characteristics of patients with coronary artery disease, depending on the type of musculoskeletal status disorder
Таблица 2. Сравнительная характеристика пациентов с ИБС в зависимости от варианта нарушения костно-мышечного статуса
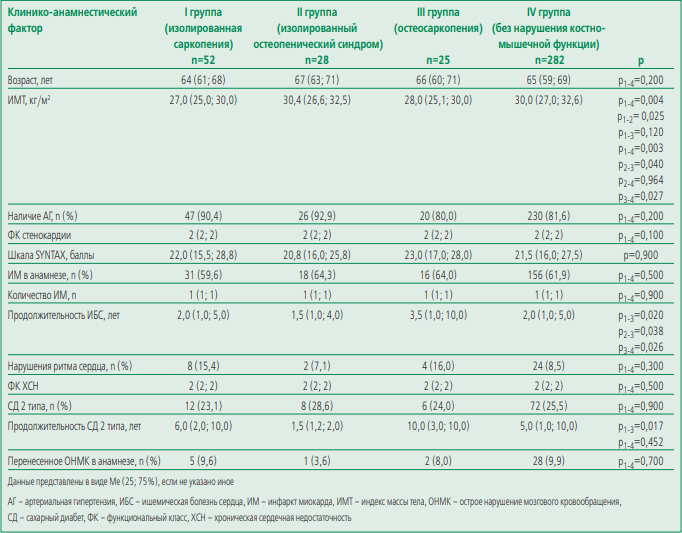
Пациенты анализируемых групп не имели статистически значимых различий в возрасте, поражении коронарного русла (по шкале SYNTAX) и основной сопутствующей патологии, за исключением длительности ИБС и сахарного диабета (СД).Так, у больных остеосаркопенией длительность ИБС была в 2,3 раза выше, чем у пациентов с остеопеническим синдромом и в 1,7 раза выше в сравнении с больными изолированной саркопенией и лицами без нарушения костно-мышечного статуса (КМС).
Аналогичная статистическая зависимость отмечена для продолжительности СД. Более длительное течение СД наблюдалось у пациентов с остеосаркопенией, наименьшая продолжительность диабета зарегистрирована в группе с изолированным остеопеническим синдромом. Пациенты с изолированной саркопенией и без нарушения КМС не имели значимых различий по длительности СД.
Большая часть участников исследования характе ́ - ризовалась избыточным весом или ожирением, оцененным по индексу массы тела (ИМТ). Наибольшие значения показателя зарегистрированы у пациентов с изолированным остеопеническим синдромом (II группа) и лиц без нарушений КМС (IV группа). Средние значения ИМТ соответствовали ожирению I степени. У больных изолированной саркопенией (I группа) и остеосаркопенией (III группа) они были ниже и соответствовали показателям избыточного веса.
Сила дыхательных мышц у пациентов с ИБС была ниже нормативных значений, причем сила экспираторных дыхательных мышц [MEP 60 (40; 80) см вод.ст.] была ниже в 1,25 раза, чем сила инспираторных [MIP 75 (42; 92) см вод.ст.], что в целом свидетельствует об исходно клинически значимой слабости дыхательной мускулатуры у данной группы больных. Выявлено, что у 191 (49,3%) пациента с ИБС оба анализируемых параметра (MEP и MIP) соответствовали норме (были выше LLN), тогда как у 196 (50,7%) участников верифицированы различные варианты снижения силы дыхательных мышц с преимущественным вариантом в виде изолированного снижения MIP [изолированное снижение MIP, 96 (24,8%), и MЕP, 25 (6,5%); сочетанное снижение MIP и MЕP 75 (19,4%)].
Сравнительный анализ параметров, характеризующих силу дыхательных мышц с учетом наличия/отсутствия исходного нарушения костно-мышечной функции, а также межгрупповой анализ пациентов, исходно имевших различные варианты нарушения КМС, представлен в табл. 3. Более низкие значения MIP (в 1,28 раза) и MEP (в 1,08 раза) отмечены у пациентов с ИБС и нарушением костно-мышечной функции в сравнении с лицами без таковых. Но даже у больных, исходно не имевших нарушения КМС, сила экспираторных мышц (MEP) была ниже нормативных значений. Однако статистически значимых различий в силе дыхательных мышц между пациентами с нарушением и без нарушения костномышечной функции не выявлено.
Сравнительный анализ MEP и MIP в зависимости от варианта нарушения костно-мышечной функции продемонстрировал закономерные изменения. Так, наименьшая сила инспираторных и экспираторных дыхательных мышц зарегистрирована в группе с изолированной саркопенией, наибольшая – в группе лиц с ИБС без нарушений КМС, при этом статистически значимых различий не получено, за исключением тенденции к различиям по уровню силы инспираторных мышц (p=0,064).
Наряду с больными, характеризующимися сниженными параметрами MEP и MIP, в каждой группе были лица, у которых анализируемые показатели были в пределах нормативных значений (рис. 1). Так, более низкие показатели (ниже LLN) силы MIP чаще встречались среди пациентов с изолированной саркопенией, соответственно, в данной группе определено наименьшее количество пациентов с нормативным значением указанного параметра. Наибольшая частота выявления лиц со сниженной силой MЕP зафиксирована среди лиц без нарушений КМС и не различалась с группами больных, исходно имевших признаки нарушения мышечной функции (изолированная саркопения, остеосаркопения). Необходимо отметить, что значимо чаще нормативные значения (выше LLN) анализируемых параметров наблюдались у пациентов с остеопеническим синдромом.
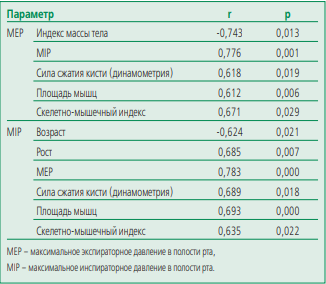
Результаты корреляционного анализа продемонстрировали умеренные статистически значимые связи силы дыхательных мышц и величины ряда клиникоинструментальных параметров (табл. 4). Так, величина MEP и MIP имела однонаправленную связь с параметрами, характеризующими мышечную функцию и свидетельствующими о нарушении мышечного статуса (сила сжатия кисти по данным динамометрии, площадь мышц и скелетно-мышечный индекс). Кроме того, по данным корреляционного анализа выявлена односторонняя зависимость MEP и MIP и разнонаправленная связь MEP и ИМТ, MIP и возраста пациента.
Table 3. Comparative characteristics of respiratory muscle strength in patients with stable coronary artery disease
Таблица 3. Сравнительная характеристика силы дыхательных мышц у пациентов со стабильной ИБС

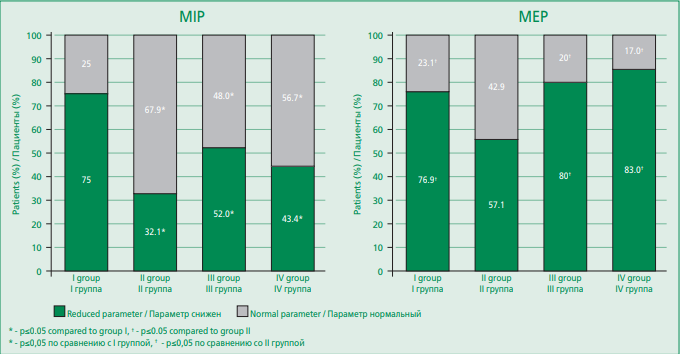
Figure 1. The strength of the respiratory muscles in patients with stable coronary heart disease, depending on the type of violation of the musculoskeletal status
Рисунок 1. Сила дыхательных мышц пациентов со стабильной ишемической болезнью сердца в зависимости от варианта нарушения костно-мышечного статус
Table 4. Results of correlation analysis of respiratory muscle strength and clinical and instrumental parameters of patients with stable coronary artery disease
Таблица 4. Результаты корреляционного анализа силы дыхательных мышц и клинико-инструментальных параметров пациентов со стабильной ишемической болезнью сердца
Обсуждение
Результаты представленного исследования позволили прийти к выводу, что у половины (50,7%) пациентов с ИБС перед КШ верифицирована клинически значимая слабость дыхательных мышц, подтверждением которой служат параметры MEP и MIP ниже нормативных значений. Выявлена тенденция более низких параметров MЕP и MIP в группе с нарушением КМС, однако без статистически значимых различий. Наибольшая степень отклонения от нормативных значений определена для показателя, характеризующего силу экспираторных мышц (MЕP). Отсутствие различий, вероятно, можно объяснить тем, что 49,3% участников исследования имели нормативные значения параметров силы дыхательных мышц. Так, даже в группе с изолированной саркопенией у четверти больных MЕP (23,1%) и MIP (25%) были в пределах нормы. Проведенный корреляционный анализ продемонстрировал связь силы дыхательных мышц с другими параметрами мышечной функции (сила сжатия кисти, площадь мышц, скелетно-мышечный индекс).
Определение силы дыхательной мускулатуры в настоящее время не является рутинным исследованием. Прежде всего, его выполняют для диагностики заболеваний центральной и периферической нервной системы, сопровождающихся слабостью дыхательных мышц. В последнее десятилетие стали появляться работы, посвященные вопросам старения, в которых рассмотрены вопросы не только изолированной слабости силы дыхательных мышц, но и одновременного снижения дыхательной функции. Саркопению дыхательных мышц, как правило, не диагностируют в клинической практике из-за отсутствия единой концепции и диагностических критериев. В действительности же патология широко распространена, преимущественно среди лиц пожилого возраста. Рабочая группа из Японии по изучению этой проблемы предложила концепцию и диагностические критерии различных вариантов нарушения функции дыхательных мышц у лиц с саркопенией. В обзоре A. Nagano и соавт. [24] представлены ряд определений и диагностические критерии таких нарушений. Так, для возрастных изменений, сопровождающихся уменьшением массы дыхательных мышц, развитием слабости дыхательной мускулатуры и снижением дыхательной функции, предложен термин presbypnea. При этом понятие респираторной саркопении предложено использовать в случае сочетания саркопении и снижения массы дыхательных мышц с последующей низкой силой дыхательных мышц и/или ухудшением дыхательной функции. Саркопеническая дыхательная недостаточность предполагает наличие дыхательной недостаточности, требующей кислородотерапии, с признаками нарушения дыхательной функции вследствие респираторной саркопении, при отсутствии клинически значимых заболеваний бронхолегочной системы.
К основным дыхательным мышцам относятся диафрагма и межреберные мышцы, которые обеспечивают вентиляцию легких в физиологических условиях. В ряде исследований показано, что сила дыхательных мышц и мышечная масса уменьшаются с возрастом, что приводит к развитию саркопении мышц диафрагмы [24]. B. Bordoni и соавт. выявили, что у пожилых людей трансдиафрагмальное давление и показатель активности диафрагмальных мышц снижаются на 20-41% при уменьшении общей силы дыхательных мышц на 30% [25]. В другой работе при аутопсии лиц пожилого возраста установлены гистопатологические аномалии в структуре диафрагмы, включая ее небольшой размер или измененную форму, а также потерю цитоплазматической целостности [26]. В исследовании P.M. Lalley снижение массы межреберных мышц ассоциировано с возрастом [27]. По данным ряда работ сила дыхательных мышц, толщина диафрагмы и дыхательная функция нарушаются у пожилых людей не только с саркопенией, но и с синдромом старческой астении. Так, пожилые люди со старческой астенией и преастенией имели значительно более низкие параметры MIP и MEP по сравнению с лицами без таковых признаков [8][28].
Результаты единичных исследований доказывают связь снижения силы дыхательных мышц с клиническими проявлениями сердечно-сосудистых заболеваний. Так, P. Verissimo и соавт. [29] показали, что у 76% пожилых пациентов, госпитализированных по поводу острой сердечной недостаточности, верифицируют слабость дыхательной мускулатуры, оцененную по уровню MIP, причем, слабость дыхательных мышц сохраняется даже после клинической стабилизации сердечной недостаточности. Данные обзора H. FernándezRubio и соавт. [30] подтверждают гипотезу, согласно которой ухудшение состояния скелетных мышц служит основной причиной симптомов хронической сердечной недостаточности. Мышечная слабость, присутствующая у лиц с хронической сердечной недостаточностью (слабость дыхательных мышц выявляют примерно у 50% больных), чаще возникает в инспираторных мышцах, чем в мышцах нижних конечностей, и является одной из основных причин непереносимости физической нагрузки. M. Riou и соавт. [31] пришли к выводу, что слабость скелетных и дыхательных мышц в значительной степени способствует снижению качества жизни и непереносимости физической нагрузки, наблюдаемых у пациентов с легочной артериальной гипертензией.
В отличие от цитируемых работ результаты настоящего исследования не подтвердили предположение о том, что для всех пациентов с саркопенией характерно снижение силы дыхательных мышц. Данный факт можно объяснить тем, что, во-первых, мы не анализировали массу дыхательных мышц и функцию дыхания, что позволило бы в полной мере диагностировать респираторную саркопению. Во-вторых, мы диагностировали саркопению в соответствии с последней версией критериев EWGSOP (2019 г.), отличающейся от предыдущих вариантов. Необходимо отметить, что даже у больных, не имевших признаков снижения массы и функции скелетных мышц (группа лиц с ИБС без нарушения костно-мышечной функции), верифицирована слабость дыхательных мышц, вероятно, обусловленная проявлением сердечной недостаточности или легочной гипертензией.
Согласно результатам выполненного нами корреляционного анализа сила дыхательных мышц имеет значимую обратную связь с возрастом, но прямую с параметрами, характеризующими мышечный статус, а именно – с силой сжатия кисти, площадью мышц и скелетно-мышечным индексом. Полученные данные согласуются с ранее представленными в литературе результатами [32-35]. Так, в исследовании H. Shin и соавт. доказано, что сила инспираторных и экспираторных мышц положительно коррелировала со скелетно-мышечным индексом (MIP r=0,451, p<0,05; MEP r=0,388, p<0,05) и с силой сжатия кисти (r=0,560, p<0,01 и r=0,393, p<0,05 соответственно). Авторы подтвердили данную связь и при проведении регрессионного анализа с поправкой на возраст, продемонстрировав корреляцию MIP с силой сжатия кисти (β=1,876, p<0,001) и скелетно-мышечным индексом (β=1,964, p=0,01), однако сила экспираторных мышц (MEP) была связана лишь с силой сжатия кисти (β=1,102, p=0,02) [32]. Авторы исследования с участием 65 бразильских пожилых людей продемонстрировали положительную корреляцию между функцией мышц нижних конечностей и силой дыхательных мышц путем измерения силы мышц сгибателей/разгибателей колена, скорости ходьбы за 6 мин и MIP/MEP [34]. К аналогичному заключению пришли H.J. Ro и соавт., доказав, что MIP коррелирует с силой разгибателей колена и силой сжатия кисти как у мужчин, так и женщин, включая молодых людей [35]. Согласно данным исследования 62 мужчин, проживающих в домах ухода в Турции, MIP в значительной степени связан с силой сжатия кисти независимо от других факторов [33].
С учетом коморбидного фона, возрастных особенностей пациентов, поступающих для планового кардиохирургического лечения, вопросам преабилитации в настоящее время уделяют значительное внимание ввиду более высоких рисков осложнений госпитального периода. По-видимому, оценка силы дыхательных мышц перед КШ должна входить в стандарт предоперационного обследования больных для составления программ преабилитации. Доказано, что тренировка дыхательных мышц может быть эффективна в улучшении не только общей физической, но и дыхательной функции и мышечной силы. Тренировка дыхательных мышц приводит к снижению выраженности одышки (от уровня базового индекса одышки), повышению толерантности к физической нагрузке, оцененной в тесте 6-минутной ходьбы у пациентов с хронической обструктивной болезнью легких [36], положительно влияет на максимальное давление выдоха у взрослых [37] и увеличивает силу скелетных мышц у пожилых людей с саркопенией [38]. Недавно проведенный метаанализ продемонстрировал, что тренировка дыхательных мышц улучшает их силу, функцию легких (повышает объем форсированного выдоха за первую секунду и форсированную жизненную способность легких), толерантность к физическим нагрузкам (увеличивает дистанцию в тесте 6 минутной ходьбы), а также сокращает продолжительность пребывания в стационаре после операции на сердце [12]. Кроме того, по результатам недавнего исследования больных COVID-19, применение методики тренировки дыхательной мускулатуры способствовало улучшению скоростных, объемных показателей функции внешнего дыхания и диффузионной способности легких [39]. Также ряд ученых продемонстрировали, что потерю массы и функции дыхательных мышц можно предупредить с помощью программы тренировки инспираторных и экспираторных мышц, что в итоге приводит к увеличению силы дыхательных мышц у пожилых людей с малоподвижным образом жизни [32].
Ограничения исследования. Ограничением данного исследования является небольшое число включенных пациентов с различными нарушениями костно-мышечного статуса, что может оказать влияние на мощность полученных результатов.
Заключение
У половины пациентов с ИБС перед КШ диагностируют клинически значимую слабость дыхательных мышц, оцениваемую при измерении MEP и MIP. Наиболее низкие значения характерны для силы экспираторных мышц (MEP), что свидетельствует о дисфункции преимущественно межреберных мышц и мышц брюшной стенки в сравнении с мышцами диафрагмы. В исследовании не выявлено статистически значимых различий в силе дыхательной мускулатуры между лицами с нарушением КМС (включая различные варианты) и изолированной ИБС, несмотря на более низкие медианы MЕP и MIP в группе с нарушенной костно-мышечной функцией. Данные корреляционного анализа подтвердили связь силы дыхательных мышц с параметрами, характеризующими мышечную функцию. Полученные результаты демонстрируют необходимость теста оценки силы дыхательных мышц у пациентов перед КШ для последующего персонифицированного подхода к преи реабилитации.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Исследование выполнено в рамках гранта РНФ 22-15-00305 «Патофизиологические особенности формирования остеосаркопенического ожирения при мультифокальном атеросклерозе как маркера биологического старения».
Financing. The study was funded by the Russian Science Foundation (grant number 22-15-00305 “Pathophysiological features of osteosarcopenic obesity in patients with multifocal atherosclerosis as a marker of biological aging”).
Список литературы
1. Fraser HC, Kuan V, Johnen R, et al. Biological mechanisms of aging predict age-related disease cooccurrence in patients. Aging Cell. 2022;21(4):e13524. DOI:10.1111/acel.13524.
2. Farr JN, Almeida M. The Spectrum of Fundamental Basic Science Discoveries Contributing to Organismal Aging. J Bone Miner Res. 2018;33(9):1568-84. DOI:10.1002/jbmr.3564.
3. Kirk B, Zanker J, Duque G. Osteosarcopenia: epidemiology, diagnosis, and treatment-facts and numbers. J Cachexia Sarcopenia Muscle. 2020;11(3):609-18. DOI:10.1002/jcsm.12567.
4. Vilaro J, Ramirez-Sarmiento A, Juana MA, et al. Global muscle dysfunction as a risk factor of readmission to hospital due to COPD exacerbations. Respir Med. 2010;104(12):1896-902. DOI:10.1016/j.rmed.2010.05.001.
5. Kera T, Kawai H, Hirano H, et al. Definition of Respiratory Sarcopenia With Peak Expiratory Flow Rate. J Am Med Dir Assoc. 2019;20(8):1021-5. DOI:10.1016/j.jamda.2018.12.013.
6. Vang P, Vasdev A, Zhan WZ, et al. Diaphragm muscle sarcopenia into very old age in mice. Physiol Rep. 2020;8(1):e14305. DOI:10.14814/phy2.14305.
7. Greising SM, Mantilla CB, Gorman BA, et al. Diaphragm muscle sarcopenia in aging mice. Exp Gerontol. 2013;48(9):881-7. DOI:10.1016/j.exger.2013.06.001.
8. Ohara DG, Pegorari MS, Oliveira Dos Santos NL, et al. Respiratory Muscle Strength as a Discriminator of Sarcopenia in Community-Dwelling Elderly: A Cross-Sectional Study. J Nutr Health Aging. 2018;22(8):952-8. DOI:10.1007/s12603-018-1079-4.
9. Greising SM, Mantilla CB, Medina-Martmez JS, et al. Functional impact of diaphragm muscle sarcopenia in both male and female mice. Am J Physiol Lung Cell Mol Physiol. 2015;309(1):L46-52. DOI:10.1152/ajplung.00064.2015.
10. Shakouri SK, Salekzamani Y, Taghizadieh A, et al. Effect of respiratory rehabilitation before open cardiac surgery on respiratory function: a randomized clinical trial. J Cardiovasc Thorac Res. 2015;7(1):13-7. DOI:10.15171/jcvtr.2015.03.
11. Chen X, Hou L, Zhang Y, et al. The effects of five days of intensive preoperative inspiratory muscle training on postoperative complications and outcome in patients having cardiac surgery: a randomized controlled trial. Clin Rehabil. 2019;33(5):913-22. DOI:10.1177/0269215519828212.
12. Dsouza FV, Amaravadi SK, Samuel SR, et al. Effectiveness of Inspiratory Muscle Training on Respiratory Muscle Strength in Patients Undergoing Cardiac Surgeries: A Systematic Review With Meta-Analysis. Ann Rehabil Med. 2021;45(4):264-73. DOI:10.5535/arm.21027.
13. Moreira JMA, Grilo EN. Quality of life after coronary artery bypass graft surgery - results of cardiac rehabilitation programme. J Exerc Rehabil. 2019;15(5):715-22. DOI:10.12965/jer.1938444.222.
14. Osailan A, Abdelbasset WK. Exercise-based cardiac rehabilitation for postcoronary artery by-pass grafting and its effect on hemodynamic responses and functional capacity evaluated using the Incremental Shuttle Walking Test: A retrospective pilot analysis. J Saudi Heart Assoc. 2020;32(1):25-33. DOI:10.37616/2212-5043.1005.
15. Российские клинические рекомендации. Коронарное шунтирование больных ишемической болезнью сердца: реабилитация и вторичная профилактика. КардиоСоматика. 2016;7(3-4):5-71. DOI:10.26442/CS45210.
16. Иванов С.В., Сумин А.Н. Современные тенденции рутинной реваскуляризации миокарда. Комплексные Проблемы Сердечно-сосудистых Заболеваний. 2021;10(2):25-35. DOI:10.17802/2306-1278-2021-10-2-25-35.
17. Cruz-Jentoft AJ, Bahat G, Bauer J, et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019;48(1):16-31. DOI:10.1093/ageing/afy169.
18. Мельниченко Г.А., Белая Ж.Е., Рожинская Л.Я., и др. Федеральные клинические рекомендации по диагностике, лечению и профилактике остеопороза. Проблемы Эндокринологии. 2017;63(6):392-426. DOI:10.14341/probl2017636392-426.
19. Баздырев Е.Д., Терентьева Н.А., Кривошапова К.Е., и др. Распространенность вариантов нарушения костно-мышечного статуса у пациентов с ишемической болезнью сердца. Рациональная Фармакотерапия в Кардиологии. 2021;17(3):369-75. DOI:10.20996/1819-6446-2021-06-03.
20. American Thoracic Society/European Respiratory Society. ATS/ERS Statement on respiratory muscle testing. Am J Respir Crit Care Med. 2002;166(4):518-624. DOI:10.1164/rccm.166.4.518.
21. Mora Romero UJ, Gochicoa Rangel L, Guerrero Zúñiga S, et al. Maximal inspiratory and expiratory pressures: Recommendations and procedure. Neumol Cir Torax. 2019;78(Supl.2):S135-S141. (in Spanish) DOI:10.35366/NTS192F.
22. Evans JA, Whitelaw WA. The assessment of maximal respiratory mouth pressures in adults. Respir Care. 2009;54(10):1348-59.
23. Laveneziana P, Albuquerque A, Aliverti A, et al. ERS Statement on Respiratory Muscle Testing at Rest and during Exercise. Eur Respir J. 2019;53(6):1-34. DOI:10.1183/13993003.01214-2018.
24. Nagano A, Wakabayashi H, Maeda K, et al. Respiratory Sarcopenia and Sarcopenic Respiratory Disability: Concepts, Diagnosis, and Treatment. J Nutr Health Aging. 2021;25(4):507-15. DOI:10.1007/s12603-021-1587-5.
25. Bordoni B, Morabito B, Simonelli M. Ageing of the Diaphragm Muscle. Cureus. 2020;12(1):e6645. DOI:10.7759/cureus.6645.
26. Nucci RAB, de Souza RR, Suemoto CK, et al. Diaphragm muscle structure in the elderly: Findings from an autopsy study. Acta Histochem. 2020;122(2):151487. DOI:10.1016/j.acthis.2019.151487.
27. Lalley PM. The aging respiratory system--pulmonary structure, function and neural control. Respir Physiol Neurobiol. 2013;187(3):199-210. DOI:10.1016/j.resp.2013.03.012.
28. Kera T, Kawai H, Hirano H, et al. Relationships among peak expiratory flow rate, body composition, physical function, and sarcopenia in community-dwelling older adults. Aging Clin Exp Res. 2018;30(4):331-40. DOI:10.1007/s40520-017-0777-9.
29. Verissimo P, Timenetsky KT, Casalaspo TJA, et al. High Prevalence of Respiratory Muscle Weakness in Hospitalized Acute Heart Failure Elderly Patients. PLoS One. 2015;10(2):e0118218. DOI:10.1371/journal.pone.0118218.
30. Fernández-Rubio H, Becerro-de-Bengoa-Vallejo R, Rodríguez-Sanz D, et al. Unraveling the Role of Respiratory Muscle Metaboloreceptors under Inspiratory Training in Patients with Heart Failure. Int J Environ Res Public Health. 2021;18(4):1697. DOI:10.3390/ijerph18041697.
31. Riou M, Pizzimenti M, Enache I, et al. Skeletal and Respiratory Muscle Dysfunctions in Pulmonary Arterial Hypertension. J Clin Med. 2020;9(2):410. DOI:10.3390/jcm9020410.
32. Shin HI, Kim DK, Seo KM, et al. Relation Between Respiratory Muscle Strength and Skeletal Muscle Mass and Hand Grip Strength in the Healthy Elderly. Ann Rehabil Med. 2017;41(4):686-92. DOI:10.5535/arm.2017.41.4.686.
33. Bahat G, Tufan A, Ozkaya H, et al. Relation between hand grip strength, respiratory muscle strength and spirometric measures in male nursing home residents. Aging Male. 2014;17(3):136-40. DOI:10.3109/13685538.2014.936001.
34. Giua R, Pedone C, Scarlata S, et al. Relationship between respiratory muscle strength and physical performance in elderly hospitalized patients. Rejuvenation Res. 2014;17(4):366-71. DOI:10.1089/rej.2014.1549.
35. Ro HJ, Kim DK, Lee SY, et al. Relationship Between Respiratory Muscle Strength and Conventional Sarcopenic Indices in Young Adults: A Preliminary Study. Ann Rehabil Med. 2015;39(6):880-7. DOI:10.5535/arm.2015.39.6.880.
36. Beaumont M, Forget P, Couturaud F, Reychler G. Effects of inspiratory muscle training in COPD patients: A systematic review and meta-analysis. Clin Respir J. 2018;12(7):2178-88. DOI:10.1111/crj.12905.
37. Templeman L, Roberts F. Effectiveness of expiratory muscle strength training on expiratory strength, pulmonary function and cough in the adult population: a systematic review. Physiotherapy. 2020;106:43-51. DOI:10.1016/j.physio.2019.06.002.
38. Cebria I Iranzo MA, Balasch-Bernat M, Tortosa-Chulia MA, Balasch-Parisi S. Effects of Resistance Training of Peripheral Muscles Versus Respiratory Muscles in Older Adults With Sarcopenia Who are Institutionalized: A Randomized Controlled Trial. J Aging Phys Act. 2018;26(4):637-46. DOI:10.1123/japa.2017-0268.
39. Liu K, Zhang W, Yang Y, et al. Respiratory rehabilitation in elderly patients with COVID-19: A randomized controlled study. Complement Ther Clin Pract. 2020;39:101166. DOI:10.1016/j.ctcp.2020.101166.
Об авторах
Е. Д. БаздыревРоссия
Баздырев Евгений Дмитриевич.
Кемерово.
eLibrary SPIN 4545-0791
Н. А. Терентьева
Россия
Терентьева Наталья Александровна.
Кемерово.
eLibrary SPIN 1323-2050
Н. А. Галимова
Россия
Галимова Наталья Александровна.
Кемерово.
eLibrary SPIN 9296-4964
К. Е. Кривошапова
Россия
Кривошапова Кристина Евгеньевна.
Кемерово.
eLibrary SPIN 4272-7552
О. Л. Барбараш
Россия
Барбараш Ольга Леонидовна.
Кемерово.
eLibrary SPIN 5373-7620
Рецензия
Для цитирования:
Баздырев Е.Д., Терентьева Н.А., Галимова Н.А., Кривошапова К.Е., Барбараш О.Л. Сила дыхательных мышц у пациентов с ишемической болезнью сердца и различными вариантами нарушения костно-мышечной функции. Рациональная Фармакотерапия в Кардиологии. 2022;18(4):393-401. https://doi.org/10.20996/1819-6446-2022-08-04
For citation:
Bazdyrev E.D., Terentyeva N.A., Galimova N.A., Krivoshapova K.E., Barbarash O.L. Respiratory Muscle Strength in Patients with Coronary Heart Disease and Different Musculoskeletal Disorders. Rational Pharmacotherapy in Cardiology. 2022;18(4):393-401. https://doi.org/10.20996/1819-6446-2022-08-04

















































