Перейти к:
Аритмогенный пролапс митрального клапана: новые угрозы известного заболевания
https://doi.org/10.20996/1819-6446-2023-01-05
Аннотация
Пролапс митрального клапана (ПМК) в течение длительного времени остается предметом интенсивных дискуссий относительно прогноза и дальнейшей тактики ведения. В подавляющем большинстве случаев это состояние имеет доброкачественный прогноз. Однако результаты недавних секционных исследований и наблюдения показывают риски развития внезапной сердечной смерти (ВСС) в некоторых подгруппах пациентов, имеющих этот клинический феномен. Представленный обзор литературы описывает популяцию пациентов с ПМК в наибольшей степени подверженных развитию жизнеугрожающих желудочковых тахиаритмий. Пациенты с наличием комплекса изменений, включающих, двустворчатый ПМК, отрицательные зубцы Т в нижних и боковых отведениях на стандартной электрокардиограмме (ЭКГ) в 12 отведениях и особый анатомический феномен, называемый митрально-аннулярное разъединение (mitral annular disjunction – MAD), имеют высокий риск развития желудочковых эктопий и ВСС. Отражением высокого риска ВСС у таких пациентов является нарастание желудочковой эктопии по данным холтеровского мониторирования. Наличие двухстворчатого ПМК и феномена MAD, заключающегося в отделении линии при- крепления задней створки митрального клапана от базального сегмента нижней стенки левого желудочка далее в полость левого предсердия, определяет наличие особой формы ПМК, так называемого аритмогенного ПМК. Таким образом, ПМК в подавляющем большинстве случаев имеет доброкачественный прогноз. Однако пациенты, имеющие перечисленные признаки аритмогенного ПМК, требуют особенно тщательного, ежегодного наблюдения с контролем ЭКГ, холтеровского мониторирования и эхокардиографического исследования сердца для уменьшения рисков желудочковых тахиаритмий и ВCС.
Ключевые слова
Для цитирования:
Кужель Д.А., Матюшин Г.В., Савченко Е.А. Аритмогенный пролапс митрального клапана: новые угрозы известного заболевания. Рациональная Фармакотерапия в Кардиологии. 2023;19(1):77-82. https://doi.org/10.20996/1819-6446-2023-01-05
For citation:
Kuzhel D.A., Matyushin G.V., Savchenko E.A. Arrhythmic Mitral Valve Prolapse: New Menaces of the Known Disease. Rational Pharmacotherapy in Cardiology. 2023;19(1):77-82. (In Russ.) https://doi.org/10.20996/1819-6446-2023-01-05
Введение
Аускультативный феномен среднесистолического щелчка и позднесистолического шума был известен начиная с XIX века. Однако только в 1963 году южноафриканский кардиолог J. B. Barlow дал объяснение этому феномену, а позднее J. M. Criley определил это состояние как пролапс митрального клапана [1][2]. С этой поры пролапс митрального клапана (ПМК) является предметом оживленных дискуссий в кардиологическом сообществе, подтверждая определение как «одного из наиболее важных и наиболее запутанных приложений» [3] не только с точки зрения ультразвуковой диагностики, но и оценки кардиологических рисков и тактики ведения.
История и современное состояние вопроса
ПМК, как известно, определяется как систолический прогиб одной или обеих створок митрального клапана в полость левого предсердия. Первые популяционные исследования, проводимые в 80-е годы прошлого столетия, давали результаты распространенности этого состояния до 15% в общей популяции, а среди молодых лиц и женщин – до 20-40% [4]. Более жёсткие критерии диагностики ПМК, требующие прогиба створок на 2 мм выше плоскости митрального кольца, определяемого прежде всего в парастернальном доступе длинной оси, согласно Фрамингемскому исследованию, практически на порядок уменьшили распространённость этого состояния и свели к цифрам 22,5% в общей популяции, без возрастных и половых различий [5][6]. В этом же исследовании ни один из пациентов с ПМК не имел в анамнезе эпизодов внезапной смерти, а частота встречаемости фибрилляции предсердий, цереброваскулярных событий, синкопальных эпизодов, одышки, боли в груди и изменений на электрокардиограмме (ЭКГ) была схожей с частотой встречаемости среди лиц, не имеющих ПМК [7]. Несмотря на то, что нередко среди лиц с ПМК на ЭКГ наблюдались нарушения реполяризации, было принято относить эти изменения к неспецифическим, выявленные нарушения ритма – к не угрожающим жизни, а случаи внезапной смерти – к наличию сопутствующей кардиомио- или каналопатии [8].
Казалось бы, вопрос с отношением к ПМК был закрыт, и в отсутствие прогрессирующей миксоматозной дегенерации створок и деструкции клапанного аппарата, вызывающего развитие сопутствующей выраженной митральной недостаточности, эти пациенты имеют благоприятный прогноз. Однако секционные исследования лиц, умерших в результате внезапной сердечной смерти (ВСС), и лиц, перенесших внезапную смерть, показали несколько другие данные. Так, проведенный метаанализ 23 исследований ВСС, включавший 38 054 события, выявил неустановленные причины летального исхода в 22,1% случаев, из них у 11,7% лиц наблюдался ПМК. У подавляющего числа лиц с ПМК, перенесших ВСС, имелись комплексные желудочковые нарушения ритма, включавшие частые, парные и групповые желудочковые экстрасистолы по типу пароксизмов неустойчивой желудочковой тахикардии, также было отмечено преобладание женщин молодого и среднего возраста [9-11].
Не все пролапсы одинаковы
Итак, почему же разные исследования дали столь противоречивые результаты? Еще в 1876 году J. Henle описал анатомический феномен смещения линии прикрепления задней створки митрального клапана от стенки левого желудочка далее в полость левого предсердия [12]. Позднее феномен так называемого митрально-аннулярного разъединения (mitral annular disjunction – MAD) был подтверждён другими авторами [13][14] и первоначально расценивался как вариант нормального развития сердца. Так, небольшое, в пределах 3,0 мм смещение основания задней створки в полость левого предсердия, описывалось у 96% здоровых лиц [15]. Однако уже в 1981 г. S. Bharati с соавторами впервые описал случай ВСС у пациента с MAD и ПМК, а в 1986 г. G.M. Hutchins с соавторами указал на частое сосуществование этих состояний (рис. 1) [16][17]. Более поздние исследования показали взаимосвязь MAD с ПМК, дилатацией кольца митрального клапана, нарушениями реполяризации при выполнении ЭКГ в 12 отведениях в нижних и боковых отведениях и частыми, комплексными желудочковыми аритмиями, причём пациенты с ПМК и аритмиями были значительно моложе с преобладанием женщин (рис. 2) [18-21]. Общая частота аритмических событий и ВСС в популяции лиц с ПМК в настоящее время оценивается как 0,14-0,2% ежегодно [9][10][22]. Имеющиеся ассоциации между ПМК, MAD, нарушениями реполяризации на ЭКГ, желудочковыми аритмиями и ВСС позволили некоторым авторам выделить особую аритмическую форму ПМК [23][24]. Интересно, что по данным некоторых исследований тяжесть желудочковых аритмий была связана с наличием MAD, тяжестью ПМК, наличием нарушений реполяризации, но не с тяжестью митральной регургитации или фракцией выброса левого желудочка (ЛЖ) [11][21][24]. По данным других исследований тяжесть желудочковых аритмий также коррелировала со степенью смещения задней створки при MAD, при этом нарушения ритма наблюдались независимо от наличия или отсутствия ПМК [19].

Figure 1. Echocardiogram of patient X. with complaints of discomfort in the chest as cardialgia.
Рисунок 1. Эхокардиограмма пациентки Х. с жалобами на ощущение дискомфорта в грудной клетке по типу кардиалгии.
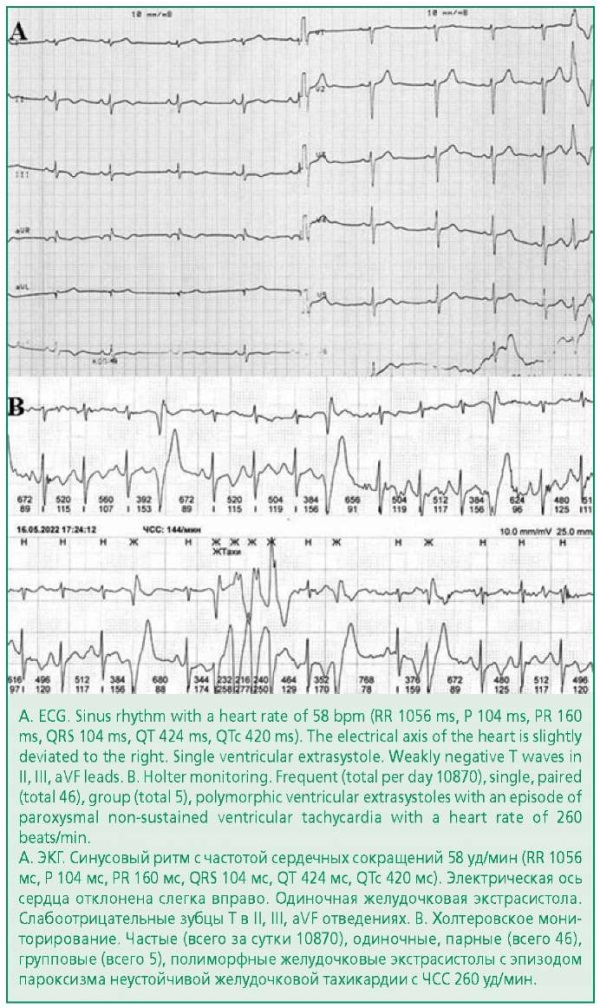
Figure 2. Electrocardiogram and a fragment of Holter monitoring of a 14-year-old patient with complaints of non-rhythmic heartbeat. Echocardiography revealed bicuspid mitral valve prolapse and mitral annular disjunction.
Рисунок 2. Электрокардиограмма и фрагмент холтеровского мониторирования пациентки 14 лет с жалобами на неритмичное сердцебиение. По данным эхокардиографии выявлен двухстворчатый пролапс митрального клапана и mitral annular disjunction.
Патогенез желудочковых нарушений ритма и внезапной смерти при ПМК и MAD
В нормальном сердце кольцо митрального клапана во время систолы ЛЖ осуществляет сфинктерную функцию, сокращаясь вместе со стенкой ЛЖ. У пациентов с MAD в результате смещения задней створки в полость левого предсердия происходит расширение кольца и развитие аномальной тяги, спроецированной на митральный клапан. В результате этого происходит систолическое напряжение прилежащей к задней створке митрального клапана задней/нижней стенки ЛЖ и заднемедиальной папиллярной мышцы с последующим развитием гипертрофии и очагов фиброза в этих сегментах миокарда. Появившиеся очаги фиброза в свою очередь будут являться источниками фокальной эктопической активности. Пусковым механизмом, вызывающим развитие тяжёлых форм желудочковых аритмий, может быть нарастание тяжести митральной регургитации и/или физическая нагрузка, приводящие к симпатоадреналовой активации, дающей в свою очередь проаритмический эффект [18][23][25]. Предрасположенность к двухстворчатому, аритмогенному ПМК имеет генетическую основу и связана с мутацией белка филамина С саркомеров сердца, которая также наблюдается при дилатационной и гипертрофической кардиомиопатиях [26].
Диагностика аритмогенного ПМК
Наличие в анамнезе у пациента с ПМК жалоб на эпизоды пресинкопе или синкопе должно служить побудительным мотивом к поиску других характерных признаков аритмогенного ПМК. Особое внимание необходимо уделять молодым женщинам [21][27][28]. При объективном осмотре может наблюдаться характерная для классического ПМК аускультативная картина – среднесистолический щелчок и позднесистолический шум. При проведении ЭКГ-исследования необходимо искать нарушения реполяризации в нижних и боковых отведениях, такие как депрессия сегмента ST, отрицательные зубцы Т в отведениях II, III, aVF, V5-V6. Во время холтеровского мониторирования могут быть выявлены частые, одиночные и групповые, полиморфные желудочковые экстрасистолы, часто с комплексами QRS по типу полной блокады правой ножки пучка Гиса (см. рис. 2) [9][18][28].
Наконец эхокардиография (ЭХОКГ) покажет двухстворчатый ПМК, расширенное кольцо митрального клапана и MAD. MAD может определяться практически во всех позициях как смещение точки прикрепления задней створки от задней стенки ЛЖ (см. рис. 1). Несмотря на то, что была показана зависимость тяжести желудочковых аритмий от степени смещения задней створки [19][24], в настоящее время нет утвержденных референтных значений для определения клинически значимого MAD. Наиболее диагностически точными показателями предложены значения 6 мм для трансторакальной ЭХОКГ и 4 мм – для чреспищеводной ЭХОКГ [5].
Другим признаком злокачественного ПМК и MAD может быть наличие так называемого «систолического завитка» (systolic curling motion), определяемого как утолщение базального сегмента нижней стенки (см. рис. 1) более 15 мм по сравнению с толщиной остальной части задней стенки [10][28][29]. Следствием напряжения базального сегмента нижней стенки будет являться увеличение пиковой скорости систолической волны импульсно-волнового тканевого Допплера при исследовании базального сегмента нижней стенки, так называемый признак Pickelhaube (рис. 3). Названный по причине схожести с наконечником прусского военного шлема признак представляет собой увеличение пика S тканевого Допплера ≥16 см/сек [27][30].
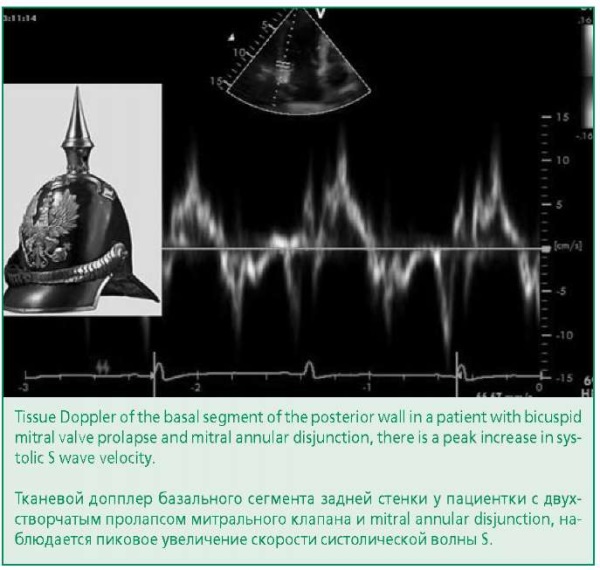
Figure 3. Left. Pickelhaube, a pointed metal helmet worn in the 19th and 20th centuries, mainly by members of the German armed forces.
Right. Sign of Pickelhaube.
Рисунок 3. Слева. Pickelhaube, остроконечный металлический шлем, носившийся в XIX в XX веках, преимущественно военнослужащими германских вооруженных сил.
Справа. Признак Pickelhaube.
Оценка глобальной продольной деформации у лиц с аритмогенным ПМК может выявить снижение показателей при наличии симптоматической желудочковой эктопии. Также с риском желудочковых эктопий может быть связан индекс механической дисперсии, определяемый как стандартное отклонение времени от начала комплекса QRS к пиковой продольной деформации каждого сегмента ЛЖ, который указывает на разнородность сокращения различных сегментов ЛЖ [21]. Снижение глобальной продольной деформации и увеличение индекса механической дисперсии указывает на тонкое ухудшение систолической функции ЛЖ и увеличение риска желудочковых эктопий. Является ли это следствием длительного механического стресса, вызываемого ПМК, или результатом развития сопутствующей кардиомиопатии, неизвестно. Также неизвестно, может ли раннее хирургическое вмешательство у таких лиц с ПМК, отягощенных угрозой развития нарушений ритма, предотвратить подобного рода неблагоприятный сценарий развития заболевания [21][28].
Магнитно-резонансная томография (МРТ) позволяет выявлять MAD уже при смещении задней створки митрального клапана на 2 мм от задней стенки ЛЖ. Распространённость MAD среди пациентов с ПМК, по данным МРТ, может достигать 42% [5]. Другим важным преимуществом МРТ является определение очагов фиброза в заднемедиальной папиллярной мышце и базальном сегменте нижней/задней стенки [5][18]. Дилатация ЛЖ и выявляемые очаги фиброза у лиц с аритмогенным ПМК и минимальной митральной регургитацией вызывают вопрос о возможном развитии у таких пациентов сопутствующей кардиомиопатии [31].
Тактика ведения лиц с аритмогенным ПМК
К факторам риска аритмогенного ПМК относят следующие признаки:
- молодой возраст,
- женский пол,
- наличие в анамнезе пресинкопе или синкопе,
- среднесистолический щелчок при аускультации,
- отрицательные зубцы Т в нижне-боковых отведениях на ЭКГ, подъем сегмента ST, удлинение интервала QT,
- полиморфные, частые желудочковые экстрасистолы с морфологией блокады правой ножки пучка Гиса,
- двустворчатый ПМК, MAD, систолический «завиток» (curling) при ультразвуковом исследовании сердца,
- задержка гадолиния в нижне-базальном сегменте и папиллярных мышцах на МРТ [10].
Клинические рекомендации по профилактике ВСС не рассматривают ПМК как фактор риска. Имплантация кардиовертера-дефибриллятора лицам с ПМК показана только в качестве вторичной профилактики при наличии документированного эпизода фибрилляции желудочков [32][33]. В то же время, согласно рекомендациям Американского колледжа кардиологии, наличие синкопе, предположительно связанного с желудочковой аритмией, может быть причиной для рассмотрения вопроса об имплантации кардиовертера-дефибриллятора или проведения электрофизиологического исследования для стратификации риска ВСС [34].
Клинические рекомендации по физической активности и занятиям спортом оценивают риски лиц с ПМК в отсутствие выраженной митральной регургитации как очень низкие [36]. Однако уже в этих рекомендациях имеются требования к проведению ЭКГ, холтеровскому мониторированию и нагрузочной пробе, а у лиц с отрицательными зубцами Т в нижних отведениях и доказательством желудочковых аритмий – и МРТ для исключения фокального фиброза. Наличие двустворчатого ПМК, отрицательных зубцов Т в нижних отведениях, фиброза в нижней/боковой стенке, присутствие комплексных желудочковых аритмий и семейного анамнеза ВСС считаются достаточным для отстранения от конкурентных спортивных занятий [10][35].
Всё же, несмотря на относительно невысокие риски развития аритмогенного ПМК, наличие огромного числа пациентов с этим диагнозом определяет достаточно большое число лиц, находящихся в опасности по развитию ВСС. Поэтому у всех пациентов с установленным диагнозом ПМК требуется стратификация риска [5][10][11][36].
- Лица с установленным диагнозом ПМК требуют оценки ЭКГ для выявления нарушений реполяризации и тщательной оценки наличия MAD.
- Пациентам с ПМК и нарушениями реполяризации на ЭКГ в нижних/боковых отведениях необходимо проведение холтеровского мониторирования.
- При наличии сомнительных данных относительно MAD на трансторакальной ЭХОКГ необходимо проведение чреспищеводной ЭХОКГ.
- Лицам с ПМК с симптоматикой аритмии и характерными признаками на ЭКГ и холтеровском мониторировании необходимо проведение МРТ для более точной оценки MAD и очагов фокального фиброза.
- Присутствие маркеров аритмогенного ПМК, таких как MAD, нарушений реполяризации в нижней стенке и фиброза на МРТ требует тщательного наблюдения за состоянием ритма и профилактике ВСС. Лицам с ПМК и фокальным фиброзом по данным МРТ при подозрении на синкопе аритмического генеза для дальнейшей стратификации риска возможно проведение электрофизиологического исследования для последующего решения вопроса о целесообразности имплантации кардиовертера-дефибриллятора.
- Кровным родственникам лиц с ПМК, перенесших эпизод или умерших в результате ВСС, необходимо провести генетический скрининг [5][10][11][36].
Остаётся до конца неясным, какую тактику ведения использовать у лиц с ПМК и умеренной регургитацией при наличии частых желудочковых экстрасистол? Нужно ли рассмотреть вариант оперативной коррекции ПМК для уменьшения аритмического бремени или предпочесть антиаритмическую терапию и/или радиочастотную абляцию аритмогенных очагов, либо даже имплантацию кардиовертера-дефибриллятора? Доказательная база по терапии и тактике ведения лиц с аритмогенным ПМК в настоящее время отсутствует. Лекарственная терапия пациентов с ПМК обычно подразумевает эмпирическое назначение бета-адреноблокаторов. Радиочастотная абляция аритмогенного субстрата может уменьшить аритмическую нагрузку, но не устраняет риски ВСС. Пластика или замена митрального клапана способны уменьшить перегрузку ЛЖ, но также не имеют доказательной базы относительно профилактики ВСС [20][27].
Заключение
Итак, ПМК в подавляющем большинстве числе случаев остаётся состоянием, имеющим доброкачественный прогноз с продолжительностью жизни, не отличающейся от здоровой популяции. Однако внутри общей популяции пациентов с ПМК необходимо выделять группы лиц, имеющих высокие риски развития сердечно-сосудистых осложнений. В первую очередь это лица с прогрессирующей миксоматозной дегенерацией створок и угрозой развития тяжёлых форм митральной регургитации. Другой группой пациентов с ПМК, требующих особого внимания, являются лица с MAD, нарушениями реполяризации и желудочковыми эктопиями на ЭКГ. Тщательное изучение анамнеза, проведение холтеровского мониторирования, нагрузочной пробы и МРТ необходимо для решения вопроса о тактике ведения таких пациентов. Для более точной стратификации рисков необходимо проведение рандомизированных исследований, которые позволят повысить эффективность проводимой терапии и улучшить прогноз в этой особой группе пациентов с ПМК.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Список литературы
1. Barlow JB, Pocock WA. The significance of late systolic murmurs and mid-late systolic clicks. Md State Med J. 1963;12:76-7.
2. Criley JM, Lewis KB, Humphries JO, et al. Prolapse of the mitral valve: clinical and cine-angiocardiographic findings. Br Heart J. 1966;28(4):488-96. DOI:10.1136/hrt.28.4.488.
3. Feigenbaum H. Acquired valvular heart disease. In: Feigenbaum H. Echocardiography. 5th ed. Philadelphia: Lea & Febiger; 1995.
4. Levy D, Savage D. Prevalence and clinical features of mitral valve prolapse. Am Heart J. 1987;113(5):1281-90. DOI:10.1016/0002-8703(87)90956-2.
5. Mantegazza V, Volpato V, Gripari P, et al. Multimodality imaging assessment of mitral annular disjunction in mitral valve prolapse. Heart. 2020;107(1):25-32. DOI:10.1136/heartjnl-2020-317330.
6. Savage DD, Garrison RJ, Devereux RB, et al. Mitral valve prolapse in the general population. 1. epidemiologic features: the Framingham study. Am Heart J. 1983;106(3):571-6. DOI:10.1016/0002-8703(83)90704-4.
7. Freed LA, Levy D, Levine RA, et al. Prevalence and clinical outcome of mitral-valve prolapse. N Engl J Med. 1999;341(1):1-7. DOI:10.1056/NEJM199907013410101.
8. Martini B, Basso C, Thiene G. Sudden death in mitral valve prolapse with Holter monitoring-documented ventricular fibrillation: evidence of coexisting arrhythmogenic right ventricular cardiomyopathy. Int J Cardiol. 1995;49(3):274-8. DOI:10.1016/0167-5273(95)02294-7.
9. Nalliah CJ, Mahajan R, Elliott AD, et al. Mitral valve prolapse and sudden cardiac death: a systematic review and meta-analysis. Heart. 2019;105(2):144-51. DOI:10.1136/heartjnl-2017-312932.
10. Coutsoumbas GV, Di Pasquale G. Mitral valve prolapse with ventricular arrhythmias: does it carries a worse prognosis? Eur Heart J Suppl. 2021;23(Suppl):E77-E82. DOI:10.1093/eurheartj/suab096.
11. Sriram CS, Syed FF, Ferguson ME, et al. Malignant bileaflet mitral valve prolapse syndrome in patients with otherwise idiopathic out-of-hospital cardiac arrest. J Am Coll Cardiol. 2013;62(3):222-30. DOI:10.1016/j.jacc.2013.02.060.
12. Henle J. Handbuch der systematischen Anatomie des Menschen. v. 3 pt. 1. Germany: Vieweg; 1876.
13. Zimmerman J. The functional and surgical anatomy of the heart. Ann R Coll Surg. 1966;39(6):348-66.
14. McAlpine WA. Heart and Coronary Arteries: An Anatomical Atlas for Clinical Diagnosis, Radiological Investigation, and Surgical Treatment. New York, NY: Springer-Verlag; 1975.
15. Toh H, Mori S, Izawa Y, et al. Prevalence and extent of mitral annular disjunction in structurally normal hearts: comprehensive 3D analysis using cardiac computed tomography. Eur Heart J Cardiovasc Imag. 2021;22(6):614-22. DOI:10.1093/ehjci/jeab022.
16. Bharati S, Granston AS, Liebson PR, et al. The conduction system in mitral valve prolapse syndrome with sudden death. Am Heart J. 1981;101(5):667-70. DOI:10.1016/0002-8703(81)90235-0.
17. Hutchins GM, Moore GW, Skoog DK. The association of floppy mitral valve with disjunction of the mitral annulus fibrosis. N Engl J Med. 1986;314(9):535-40. DOI:10.1056/NEJM198602273140902.
18. Basso C, Marra MP, Rizzo S, et al. Arrhythmic Mitral Valve Prolapse and Sudden Cardiac Death. Circulation. 2015;132(7):556-66. DOI:10.1161/circulationaha.115.016291.
19. Dejgaard LA, Skjølsvik ET, Lie ØH, et al. The mitral annulus disjunction arrhythmic syndrome. J Am Coll Cardiol. 2018;72(14):1600-9. DOI:10.1016/j.jacc.2018.07.070.
20. Bennett S, Thamman R, Griffiths T, et al. Mitral annular disjunction: a systematic review of the literature. Echocardiography. 2019;36(8):1549-58. DOI:10.1111/echo.14437.
21. van Wijngaarden AL, de Riva M, Hiemstra YL, et al. Parameters associated with ventricular arrhythmias in mitral valve prolapse with significant regurgitation. Heart. 2021;107(5):411-8. DOI:10.1136/heartjnl-2020-317451.
22. Han HC, Ha FJ, Teh AW, et al. Mitral valve prolapse and sudden cardiac death: a systematic review. J Am Heart Assoc. 2018;7(23):e010584. DOI:10.1161/JAHA.118.010584.
23. Chivulescu M, Aabel E, Dejgaard L, et al. Cardiac Arrest in a Patient With Arrhythmic Mitral Valve Prolapse Syndrome. Multiple Possible Etiologies. J Am Coll Cardiol Case Rep. 2021;3(16):1769-73. DOI:10.1016/j.jaccas.2021.08.019.
24. Essayagh B, Iacuzio L, Civaia F, et al. Usefulness of 3-tesla cardiac magnetic resonance to detect mitral annular disjunction in patients with mitral valve prolapse. Am J Cardiol. 2019;124(11):1725-30. DOI:10.1016/j.amjcard.2019.08.047.
25. Широбоких О. Е., Былова Н. А. Пролапс митрального клапана и внезапная сердечная смерть: кто в группе риска? Архивъ Внутренней Медицины. 2016;3(29):25-9. DOI:10.20514/2226-6704-2016-6-3-25-29.
26. Bains S, Tester DJ, Asirvatham SJ, et al. A novel truncating variant in FLNC-encoded filamin C may serve as a proarrhythmic genetic substrate for arrhythmogenic bileaflet mitral valve prolapse syndrome. Mayo Clin Proc. 2019;94(5):906-13. DOI:10.1016/j.mayocp.2018.11.028.
27. Muthukumar L, Rahman F, Jan M.F, et al. The Pickelhaube Sign: Novel Echocardiographic Risk Marker for Malignant Mitral Valve Prolapse Syndrome. JACC Cardiovasc Imaging. 2017;10(9):1078-80. DOI:10.1016/j.jcmg.2016.09.016.
28. Cipriani A, Bauce B. Ventricular arrhythmias in mitral valve prolapse: new explanations for an old problem. Heart. 2021;107(5):353-4. DOI:10.1136/heartjnl-2020-318086.
29. Haugaa K. Improving the imaging diagnosis of mitral annular disjunction. Heart. 2021;107(1):4-5. DOI:10.1136/heartjnl-2020-317667.
30. Villatore A, Sala S, Stella S, et al. Autoimmune Myocarditis and Arrhythmogenic Mitral Valve Prolapse: An Unexpected Overlap Syndrome. J Cardiovasc Dev Dis. 2021;8(11):151. DOI:10.3390/jcdd8110151.
31. Constant Dit Beaufils AL, Huttin O, Jobbe-Duval A, et al. Replacement myocardial fibrosis in patients with mitral valve prolapse: relation to mitral regurgitation, ventricular remodeling and arrhythmia. Circulation. 2021;143(18):1763-74. DOI:10.1161/CIRCULATIONAHA.120.050214.
32. Priori SG, Blomstrom-Lundqvist C, Mazzanti A, et al. ESC Scientific Document Group. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J. 2015;36(41):2793-867. DOI:10.1093/eurheartj/ehv316.
33. Лебедев Д. С., Михайлов Е. Н., Неминущий Н. М., и др. Желудочковые нарушения ритма. Желудочковые тахикардии и внезапная сердечная смерть. Клинические рекомендации 2020. Российский Кардиологический Журнал. 2021;26(7):4600. DOI:10.15829/1560-4071-2021-4600.
34. Al-Khatib SM, Stevenson WG, Ackerman MJ, et al. 2017 AHA/ACC/HRS Guideline for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guide-lines and the Heart Rhythm Society. J Am Coll Cardiol. 2018;72(14):e91-e220. DOI:10.1016/j.jacc.2017.10.054.
35. Pelliccia A, Sharma S, Gati S, et al. ESC Scientific Document Group. 2020 ESC Guidelines on sports cardiology and exercise in patients with cardiovascular disease. Eur Heart J. 2021;42(1):17-96. DOI:10.1093/eurheartj/ehaa605.
36. Higuchi K, Bhargava M. Management of premature ventricular complexes. Heart 2022;108(7):565-72. DOI:10.1136/heartjnl-2020-318628.
Об авторах
Д. А. КужельРоссия
Кужель Дмитрий Анатольевич.
Красноярск
Г. В. Матюшин
Россия
Матюшин Геннадий Васильевич.
Красноярск
Е. А. Савченко
Россия
Савченко Елена Александровна.
Красноярск
Рецензия
Для цитирования:
Кужель Д.А., Матюшин Г.В., Савченко Е.А. Аритмогенный пролапс митрального клапана: новые угрозы известного заболевания. Рациональная Фармакотерапия в Кардиологии. 2023;19(1):77-82. https://doi.org/10.20996/1819-6446-2023-01-05
For citation:
Kuzhel D.A., Matyushin G.V., Savchenko E.A. Arrhythmic Mitral Valve Prolapse: New Menaces of the Known Disease. Rational Pharmacotherapy in Cardiology. 2023;19(1):77-82. (In Russ.) https://doi.org/10.20996/1819-6446-2023-01-05

















































