Перейти к:
BRASH синдром: клинический случай
https://doi.org/10.20996/1819-6446-2024-3028
EDN: YSAYOM
Аннотация
В статье описан клинический случай развития BRASH (Bradycardia, Renal Failure, AV nodal blockade, Shock, and Hyperkalemia) синдрома у пациентки М., 1938 года рождения, страдающей артериальной гипертензией и сахарным диабетом 2 типа. Пациентка ежедневно принимала бисопролол, эплеренон, азилсартана медоксомил, лерканидипина гидрохлорид. Поступила в стационар с жалобами на общую слабость, потемнение в глазах, тошноту, кратковременную потерю сознания, редкий пульс, диарею накануне. При обследовании выявлены выраженная синусовая брадикардия (38 уд./мин) и преходящая атриовентрикулярная (АВ) блокада 1 степени, хроническая болезнь почек (ХБП) 4 стадии с гиперкалиемией (калий 5,53-6,12 ммоль/л). Пациентке были отменены пульсурежащие препараты, блокаторы ренин-ангиотензин-альдостероновой системы, назначены 0,9% раствор натрия хлорида и фуросемид. Выписана в удовлетворительном состоянии. Данный клинический случай соответствует критериям BRASH синдрома, так как на фоне приема блокатора AB-узла в небольшой дозе у пациентки с хронической болезнью почек с легкой и умеренной гиперкалиемией развились выраженная синусовая брадикардия и преходящая АВ-блокада 1 степени. Пусковыми факторами развития BRASH синдрома послужили прием азилсартана медоксомила и эплеренона, а также гиповолемия вследствие диареи.
Ключевые слова
Для цитирования:
Шалаева Д.Д., Переверзева К.Г., Фомина О.А., Якушин С.С. BRASH синдром: клинический случай. Рациональная Фармакотерапия в Кардиологии. 2024;20(3):367-373. https://doi.org/10.20996/1819-6446-2024-3028. EDN: YSAYOM
For citation:
Shalaeva D.D., Pereverzeva K.G., Fomina O.A., Yakushin S.S. BRASH syndrome: а clinical case. Rational Pharmacotherapy in Cardiology. 2024;20(3):367-373. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3028. EDN: YSAYOM
Введение
В настоящее время терапию сердечно-сосудистых заболеваний (ССЗ) невозможно представить без группы лекарственных препаратов, замедляющих проведение импульса по атриовентрикулярному (АВ) узлу (блокаторы АB-узла), основными представителями которой являются β-адреноблокаторы (β-АБ) и блокаторы медленных кальциевых каналов. Хорошо известно, что одним из возможных побочных эффектов этой группы лекарственных препаратов является брадикардия [1]. Однако обычно её удается избежать, назначая блокаторы АB-узла в терапевтических дозах, с учетом сопутствующей патологии и в рациональной комбинации [2].
В работах R. F. Bonvini и соавт. [3] и M. O. Hegazi и соавт. [4] описано, что высокий риск развития синусовой брадикардии и/или AB-блокады при приёме блокаторов АB-узла имеют пациенты с гиперкалиемией, причиной развития которой может служить хроническая болезнь почек (ХБП). В 2016 г. J. Farkas в блоге автора на ресурсе PulmCrit, а затем в научной статье назвал такой феномен BRASH синдром и впервые описал его патофизиологический механизм [5]. Данная аббревиатура включает комплекс состояний: B — Bradycardia (брадикардия), R — Renal failure (почечная недостаточность/ХБП), A — AV node blocker (блокада [5-6]/блокатор АВ-узла [7-9]), S — Shock (шок), H — Hyperkalemia (гиперкалиемия). Брадикардия — результат сочетанного эффекта применения блокаторов АB-узла и гиперкалиемии, возникающей из-за ХБП, что приводит к снижению сердечного выброса, вызывая гипоперфузию органов, в том числе почек и, в свою очередь, определяет клиническую картину шока и усугубляет ХБП, провоцируя прогрессирование гиперкалиемии [5].
Таким образом, патогенез BRASH синдрома представляет собой "порочный круг" замыкания патофизиологических механизмов и нарастания неблагоприятных клинических синдромов [5]. При отсутствии своевременных диагностики и лечения, данное состояние может служить причиной развития полиорганной недостаточности и летального исхода [5].
Цель статьи — продемонстрировать клинический случай развития BRASH синдрома у пациентки с ХБП, принимающей блокаторы АB-узла для лечения гипертонической болезни.
Описание клинического случая
Пациентка М., 1938 года рождения, поступила в кардиологический стационар 15.08.2023 в 02:55 с жалобами на общую слабость, ощущение потемнения в глазах, тошноту, кратковременную потерю сознания, редкий пульс при пальпации и измерении артериального давления автоматическим прибором. Из анамнеза известно, что с 1993 г. страдает артериальной гипертензией, с 2022 г. — сахарным диабетом (СД) 2 типа. Ежедневно принимает бисопролол 2,5 мг однократно утром, эплеренон 25 мг однократно утром, азилсартана медоксомил 40 мг, хлорталидон 12,5 мг в виде фиксированной комбинации однократно утром, клопидогрел 75 мг однократно утром, лерканидипина гидрохлорид 10 мг однократно вечером, розувастатин 10 мг однократно вечером, метформин 500 мг однократно утром. Настоящее ухудшение с 14.08.2023, когда утром возникла диарея, а к вечеру появились вышеописанные жалобы. Бригадой скорой медицинской помощи по данным объективного осмотра зафиксирована, но не зарегистрирована на электрокардиограмме (ЭКГ) частота сердечных сокращений (ЧСС) = 38 в минуту. Пациентка доставлена в стационар с подозрением на синдром слабости синусового узла, на зарегистрированной ЭКГ — синусовая брадикардия (рис. 1). Госпитализирована в отделение анестезиологии и реанимации (АиР).
При поступлении в АиР состояние средней степени тяжести. Сознание ясное. В легких дыхание везикулярное, хрипов нет. Частота дыхательных движений 16 в минуту. Тоны сердца ослаблены, ритм правильный. ЧСС — 56 в минуту. Артериальное давление (АД) — 140/80 мм рт.ст. Живот мягкий, безболезненный. Отеков нет. Индекс массы тела = 31,6 кг/м2.
Установлен предварительный диагноз: Основной: Гипертоническая болезнь III стадии, контролируемая. СД 2 типа. Риск сердечно-сосудистых осложнений очень высокий. Целевое АД 130-139/70-79 мм рт.ст.
Осложнения: Синусовая брадикардия на фоне передозировки пульсурежающих препаратов с эквивалентами приступов Морганьи-Адамса-Стокса от 15.08.2023. Хроническая сердечная недостаточность I стадия, функциональный класс не определен.
Сопутствующий: Хронический холецистопанкреатит, ремиссия. Хронический пиелонефрит, ремиссия. Цереброваскулярная болезнь. Хроническая ишемия головного мозга II стадии.
15.08.2023 выполнены клинический и биохимический анализы крови, показатели, выходящие за пределы референсных значений, представлены в табл. 1.
На ЭКГ при поступлении от 15.08.2023 зарегистрированы: синусовая брадикардия с ЧСС 55 в минуту; миграция водителя ритма по предсердиям; отклонение электрической оси сердца влево; изменения в верхушечно-боковой стенке левого желудочка (ЛЖ).
15.08.2023 пациентке выполнено эхокардиографическое исследование, выявлены дилатация полости левого предсердия (максимальный передне-задний размер — 5,0 см), нарушение диастолической функции ЛЖ (фракция выброса ЛЖ по Тейхольцу — 52%). Недостаточность митрального клапана (2 степени), аортального клапана (2 степени). Умеренный стеноз устья аорты (систолический градиент давления ЛЖ-аорта 36 мм рт.ст.). Легочная гипертензия (систолический градиент давления на трикуспидальном клапане 36 мм рт.ст.).
15.08.2023 пациентка осмотрена эндокринологом, установлен диагноз: СД 2 типа, диабетическая ангиоретинопатия, нефропатия, ХБП С4 (скорость клубочковой фильтрации (СКФ) по CKD-EPI — 19 мл/мин/1,73 м2), энцефалопатия. Ожирение 1 степени. Узловой зоб 1 степени. Целевой уровень гликированного гемоглобина ≤8,5%. Рекомендована отмена метформина из-за снижения СКФ.
16.08.2023 проведено лабораторное исследование крови в динамике (см. табл. 1). Была отмечена положительная динамика. Пациентка была переведена из АиР в общую палату.
21.08.2023 при Холтеровском мониторировании ЭКГ: синусовый ритм с ЧСС 57-88 уд./мин. Одиночные желудочковые экстрасистолы — 6, одиночные наджелудочковые экстрасистолы — 85, эпизоды би-тригеминии, одиночная блокированная наджелудочковая экстрасистолия с максимальной длительностью интервала R-R 2308 мс. Парная желудочковая экстрасистолия — 2. Увеличение интервала PQ до 0,22 с.
Пациентке было назначено внутривенное капельное введение 0,9% раствора хлорида натрия с добавлением фуросемида в дозировке 60 мг 1 раз в день в течение первых дней лечения. Также пациентка ежедневно принимала амлодипин 5 мг, аторвастатин 20 мг, ацетилсалициловую кислоту 100 мг, железа III гидроксид полимальтозат 100 мг, леспефлан 100 мл, после коррекции гиперкалиемии — лизиноприл 5 мг. На фоне лечения состояние улучшилось, головокружения и слабость не беспокоили.
На ЭКГ 24.08.2023 ритм синусовый, ЧСС 64 уд./мин.
Заключительный диагноз: Гипертоническая болезнь III стадии, контролируемая. Сахарный диабет 2 типа. Целевой уровень гликированного гемоглобина ≤8,5%. Ожирение 1 степени. Дислипидемия. Гиперурикемия. Риск сердечно-сосудистых осложнений очень высокий. Целевое АД 130-139/70-79 мм рт.ст.
Осложнение: Диабетическая ангиоретинопатия, нефропатия, ХБП С3Б (СКФ по CKD-EPI — 37 мл/мин/1,73 м2). Гиперкалиемия. Синусовая брадикардия на фоне передозировки пульсурежающих препаратов. Синкопальное состояние (15.08.2023). Редкая наджелудочковая экстрасистолия, би-тригеминия, парная, редкая желудочковая экстрасистолия, преходящая АВ-блокада 1 степени (Холтеровское мониторирование ЭКГ 21.08.2023). Недостаточность митрального клапана, аортального клапана (регургитация 2 степени). Легочная гипертензия (систолический градиент давления на трикуспидальном клапане 36 мм рт.ст.). Хроническая сердечная недостаточность I стадии, функциональный класс II.
Сопутствующий: Умеренный стеноз устья аорты (систолический градиент давления ЛЖ — аорта 36 мм рт.ст.). Хронический холецистопанкреатит, ремиссия. Хронический пиелонефрит, ремиссия. Цереброваскулярная болезнь. Хроническая ишемия головного мозга II стадии. Узловой зоб 1 степени. Хроническая железодефицитная анемия.
Выписана на 10-й день в удовлетворительном состоянии под амбулаторное наблюдение. Рекомендована терапия препаратами: аторвастатин 20 мг, ацетилсалициловая кислота 100 мг, фелодипин 2,5-5 мг и фозиноприл 2,5-5 мг (коррекция по уровню АД), аллопуринол 50 мг, железа III гидроксид полимальтозат 100 мг.
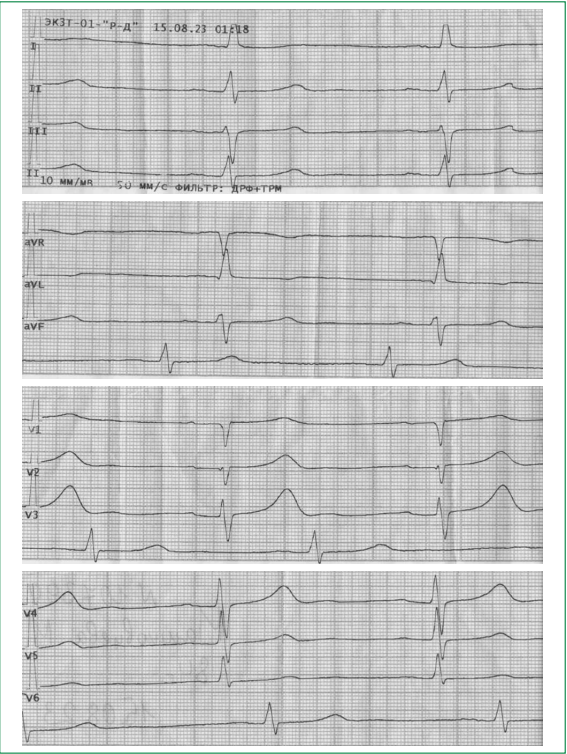
Рисунок 1. ЭКГ, зарегистрированная бригадой скорой медицинской помощи 15.08.2023. Синусовая аритмия с ЧСС 48 уд./мин. Высокие, заостренные зубцы Т в отведениях V2, V3
Таблица 1. Показатели лабораторного исследования крови
|
Показатель |
15.08.2023 |
15.08.2023 |
16.08.2023 |
|
Гемоглобин, г/л |
112 |
104 |
124 |
|
Эритроциты, ×1012/л |
3,73 |
3,61 |
4,27 |
|
Цветовой показатель, ٪ |
34,3 |
31,9 |
40,0 |
|
Лейкоциты, ×109/л |
10,56 |
8,36 |
8,63 |
|
Глюкоза, ммоль/л |
8,9 |
7,21 |
6,81 |
|
Калий, ммоль/л |
5,53 |
6,12 |
4,64 |
|
Кальций, ммоль/л |
– |
– |
2,74 |
|
Креатинин, мкмоль/л |
202 |
174,45 |
117,67 |
|
СКФ по формуле CKD-EPI, мл/мин/1,73 м2 |
19 |
23 |
37 |
|
Мочевина, ммоль/л |
17,4 |
15,17 |
12,57 |
|
Триглицериды, ммоль/л |
– |
– |
3,12 |
|
Холестерин липопротеинов низкой плотности, ммоль/л |
– |
– |
3,03 |
|
Креатинфосфокиназа, Ед/л |
164 |
127,61 |
164 |
|
Мочевая кислота, мкмоль/л |
– |
– |
525 |
|
СКФ — скорость клубочковой фильтрации, CKD-EPI — Chronic Kidney Disease Epidemiology Collaboration Formula |
|||
Таблица 2. Схема дифференциальной диагностики брадикардии
|
Критерий |
Брадикардия |
||
|
Изолированная гиперкалиемия |
BRASH синдром |
Передозировка блокаторами |
|
|
Гиперкалиемия |
Тяжёлая |
Лёгкая или умеренная (редко тяжёлая) |
В большинстве случаев нехарактерна (может возникать |
|
Изменения на ЭКГ |
Признаки гиперкалиемии и брадиаритмия |
Брадиаритмия, могут регистрироваться признаки гиперкалиемии |
Брадиаритмия без признаков гиперкалиемии |
|
Терапия блокаторами |
Необязательна |
Обязательна (в терапевтической дозировке |
Обязательна (в дозах, превышающих терапевтические и/или в нерациональной комбинации) |
|
АВ — атриовентрикулярный, β-АБ — бета-адреноблокаторы |
|||
Обсуждение
Пациенты со сниженной функцией почек, имеющие в анамнезе ССЗ, принимающие блокаторы АB-узла, имеют высокий риск BRASH синдрома [6][8][9]. Развитие брадикардии в этом случае обусловлено синергическим действием гиперкалиемии и блокаторов АB-узла [5]. Однако, гиперкалиемия и прием блокаторов AB-узла могут независимо друг от друга вызывать брадиаритмии. Основная сложность дифференциальной диагностики BRASH синдрома заключается в том, чтобы отличить его от изолированной гиперкалиемии или интоксикации блокаторами АB-узла [5][8].
Механизм действия блокаторов АB-узла основан на уменьшении тока ионов кальция внутрь кардиомиоцитов проводящей системы сердца, главным образом синоатриального и АB-узлов, что приводит к урежению ЧСС и замедлению проводимости по этим структурам [10]. Терапевтические дозы этих препаратов обычно не приводят к нарушению проводимости с развитием выраженной брадикардии [2]. Пациенты, поступающие в лечебные учреждения с брадикардией на фоне передозировки блокаторами АB-узла, отмечают, что либо принимали высокие дозы ("абсолютная передозировка"), либо принимали их нерациональную комбинацию ("относительная передозировка") или пациенты страдают ХБП [11]. Пациенты с BRASH синдромом, как правило, принимают лекарственные препараты по назначению и в подобранной дозе, используя рациональные комбинации [5]. Пусковым моментом в развитии BRASH синдрома может служить гиповолемия [9], возникающая в результате обезвоживания и последующего преренального острого повреждения почек [12]. Гиповолемия часто провоцируется желудочно-кишечными заболеваниями, такими как гастроэнтерит, или уменьшением потребления жидкости [12]. В работе P. Palmisano и соавт. описывается взаимосвязь между обезвоживанием, наблюдающемся у пожилых пациентов в жаркую погоду, и риском возникновения брадиаритмии [13]. Гиповолемия способствует усугублению почечной дисфункции и снижению СКФ, что приводит к нарушению выведения блокаторов АB-узла, вследствие чего их концентрация в крови остается высокой на протяжении длительного периода времени, что усиливает воздействие на структуры проводящей системы сердца и приводит к выраженной брадикардии [8][14]. Еще одним триггером развития BRASH синдрома может быть прием ингибиторов ангиотензинпревращающего фермента, блокаторов рецепторов ангиотензина II, антагонистов альдостерона, которые способствуют увеличению уровня калия в крови, что в свою очередь тоже приводит к брадикардии [14-16]. Неселективные β-АБ за счет их ингибирующего действия на симпатическую нервную систему уменьшают высвобождение ренина, снижают образование ангиотензина II и альдостерона и вызывают гиперкалиемию [17]. Риск гиперкалиемии у пациентов при использовании препаратов этих групп существенно возрастает при наличии ХБП и СД [15, 16].
Описана роль дигидропиридиновых блокаторов медленных кальциевых каналов в замедлении проведения по AB-узлу и развитии брадикардии у пациента с СД, что возможно связано с развитием у них автономной нейропатии [18]. В исследованиях на животных с поражением симпатических нервов дополнительные дозы нифедипина приводили к AB-блокаде, которая была сопоставима с эффектами верапамила и дилтиазема, демонстрируя дозозависимый эффект подавления AB-узла [19]. Было высказано предположение, что в условиях, когда компенсаторная симпатическая активность нарушена, как при СД, нифедипин может вызывать брадикардию [20]. Возможность амлодипина изолированно, а чаще — в комбинации с β-АБ, вызывать BRASH синдром описана рядом авторов [5, 21].
В демонстрируемом случае гиповолемия, возникшая в результате появления у пациентки диареи накануне госпитализации, а также прием азилсартана медоксомила и эплеренона, послужили причиной ухудшения функции почек и накопления в крови калия, на фоне чего прием бисопролола в минимальной дозировке привел к развитию cинусовой брадикардии и AB-блокады I степени.
По мнению ряда авторов, в том числе J. D. Farkas и соавт. [5], отличия BRASH синдрома от изолированной гиперкалиемии — относительно невысокий уровень калия в сыворотке крови (до 6,5-7 ммоль/л) и отсутствие при BRASH синдроме ЭКГ-изменений, свойственных гиперкалиемии: увеличения зубца Т, расширения, снижения амплитуды или отсутствия зубца Р, расширения комплекса QRST, синусоидального типа QRST, тахикардии и фибрилляции желудочков [22]. Действительно, во многих публикациях клинических случаев фиксируется выраженная брадикардия, связанная с легкой гиперкалиемией. В одной публикации описан пациент, принимавший верапамил, у которого развился BRASH синдром при уровне калия в сыворотке крови 5,1 ммоль/л [23], а E. F. Aziz и соавт. [24] описывают возникновение АB-блокады 3 степени у пациента с легкой гиперкалиемией. Однако уровни калия в пределах 5,5-7,0 ммоль/л документируются чаще, также описаны случаи развития BRASН синдрома при выраженной гиперкалиемии [23], в том числе более 8 ммоль/л [25].
При изолированной гиперкалиемии выраженная клиническая картина наблюдается при повышении калия в крови более 7 ммоль/л, а на ЭКГ регистрируются изменения, описанные выше [5][8]. Однако, в исследовании P. Aheel и соавт. [26] указывается, что только у 62% пациентов с уровнем калия в крови более 6,5 ммоль/л наблюдаются типичные изменения на ЭКГ, то есть данный признак — наличие/отсутствие типичных ЭКГ-изменений при изолированной гиперкалиемии и BRASH синдроме нельзя считать специфичным.
В данном клиническом случае уровень калия при поступлении составил 5,53 ммоль/л, на ЭКГ регистрировалась синусовая брадикардия с ЧСС 48-55 уд./мин, а также высокие зубцы Т в отведениях V2, V3.
Независимо от степени гиперкалиемии избыток калия является кардиотоксичным и приводит к снижению возбудимости мембран кардиомиоцитов, что приводит к усугублению брадикардии. При этом у пациентов может регистрироваться синусовая брадикардия, AB-узловой замещающий ритм, AB-блокады различной степени, в т.ч. полная AB-блокада [20]. В самом полном в настоящее время обзоре H. Majeed и соавт. приводятся следующие данные о брадиаритмиях при BRASH синдроме: "ЧСС у пациентов в среднем составляла 36 ударов в минуту; на ЭКГ обычно наблюдались узловой ритм (50%), синусовая брадикардия (17,1%) и полная AB-блокада (12,9%)" [27].
Клинические проявления BRASH синдрома у пациентов могут варьировать от бессимптомного течения до развития явлений шока [5]. В работе Y. Sattar и соавт. описано, что только у 2 из 9 пациентов с BRASH синдромом развился шок [9]. Есть обоснованное мнение, что в настоящее время недостаточно данных для того, чтобы однозначно утверждать, что при BRASH синдроме должны быть все пять его компонентов [28]. При этом самым дискутабельным компонентом является шок. Так, у некоторых пациентов АД остается нормальным, несмотря на выраженную брадикардию. Брадикардия компенсируется выраженной вазоконстриктивной реакцией, которая позволяет поддерживать АД на нормальном уровне. К сожалению, несмотря на нормальное АД, эти пациенты продолжают страдать от гипоперфузии, поскольку сердечный выброс прямо пропорционален ЧСС. Таким образом, лечение брадикардии остается важным направлением для восстановления системной перфузии и функции почек [5]. В таких случаях целью лечения должно быть предотвращение развития шока [28].
Более того, отдельные авторы признают существование не только BRASH синдрома (с шоком), но и BRAHH-синдрома, когда у пациента вместо шока наблюдается артериальная гипертензия (Н — hypertensive manifestation) [25].
В описанном случае у пациентки не наблюдалось проявлений шока, АД при поступлении составляло 140/80 мм рт.ст.
Ведущие симптомы также могут различаться. У одних пациентов на первое место будет выходить выраженная брадикардия, в то время как уровень калия будет соответствовать легкой степени гиперкалиемии [5], как в случае с нашей пациенткой. У других пациентов с тяжелой гиперкалиемией ЧСС будет снижена незначительно [5]. Об этом необходимо помнить при проведении дифференциальной диагностики.
Проанализировав данные литературы и наш клинических случай, предлагаем модифицированную схему дифференциальной диагностики брадикардии при изолированной гиперкалиемии, брадикардии при BRASH синдроме и брадикардии при передозировке блокаторами AB-узла (табл. 2).
Полагаем, что данное клиническое наблюдение соответствует критериям BRASH синдрома, так как на фоне приема блокатора AB-узла в небольшой дозе (бисопролол 2,5 мг/сутки) у пациентки с ХБП (4-3Б стадии) с легкой и умеренной гиперкалиемией (калий 5,53-6,12 ммоль/л) развилась выраженная синусовая брадикардия и преходящая АB-блокада 1 степени. Пусковыми факторами развития BRASH-cиндрома послужили прием азилсартана медоксомила и эплеренона, а также гиповолемия вследствие диареи.
Во время госпитализации и при выписке с целью предотвращения повторных эпизодов гиперкалиемии и брадикардии пациентке была изменена лекарственная терапия: отменены эплеренон и бисопролол, а азилсартана медоксомил после коррекции гиперкалиемии заменен первоначально на лизиноприл, а затем на фозиноприл. Решение о продолжении терапии ингибитором ангиотензинпревращающего фермента на фоне разрешившейся гиперкалиемии было обусловлено наличием у пациентки гипертонической болезни и гипертрофии ЛЖ, СД 2 типа и диабетической нефропатии, хронической сердечной недостаточности, при которых назначение данной группы лекарственных препаратов имеет положительное влияние на прогноз, а также — современными литературными данными о том, что сохранение терапии блокаторами ренин-ангиотензин-альдостероновой системы при поддержании нормокалиемии, в т.ч. у пациентов с предшествующей гиперкалиемией и/или на фоне лечения имеющейся гиперкалиемии, новыми препаратами, связывающими ионы калия, ассоциируется с лучшими исходами [29][30]. Первоначальный выбор лизиноприла объясняется его наличием в стационаре, последующее назначение фозиноприла — двойным путем выведения, так как действующее вещество — фозиноприлат выводится из организма в равной степени печенью и почками [31].
Заключение
Представленный клинический случай свидетельствует о возможности выявления в клинической практике BRASH синдрома, как потенциального осложнения терапии ССЗ. Понимание патофизиологических аспектов развития этого состояния поможет не только предотвратить его развитие, но и своевременно распознавать и успешно лечить пациентов.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Пациентом было подписано добровольное информированное согласие на публикацию
Список литературы
1. Kawabata M, Yokoyama Y, Sasaki T, et al. Severe iatrogenic bradycardia related to the combined use of beta-blocking agents and sodium channel blockers. Clin Pharmacol. 2015;7:29-36. DOI:10.2147/CPAA.S77021.
2. Shin J, Pletcher MJ. Risk of emergent bradycardia associated with the use of carvedilol and metoprolol in routine clinical practice. Am J Med. 2013;126(9):805-10.e5. DOI:10.1016/j.amjmed.2013.02.030.
3. Bonvini RF, Hendiri T, Anwar A. Sinus arrest and moderate hyperkalemia. Ann Cardiol Angeiol (Paris). 2006;55(3):161-3. DOI:10.1016/j.ancard.2005.10.001.
4. Hegazi MO, Aldabie G, Al-Mutairi S, El Sayed A. Junctional bradycardia with verapamil in renal failure-care required even with mild hyperkalaemia. J Clin Pharm Ther. 2012;37(6):726-8. DOI:10.1111/j.1365-2710.2012.01352.x.
5. Farkas JD, Long B, Koyfman A, Menson K. BRASH Syndrome: Bradycardia, Renal Failure, AV Blockade, Shock, and Hyperkalemia. J Emerg Med. 2020;59(2):216-23. DOI:10.1016/j.jemermed.2020.05.001.
6. Bailuni Neto JJ, Siqueira BL, Machado FC, et al. BRASH Syndrome: A Case Report. Am J Case Rep. 2022;23:e934600. DOI:10.12659/AJCR.934600.
7. Wong CK, Jaafar MJ. Bradycardia, renal failure, atrioventricular nodal blockade, shock, and hyperkalemia: An important syndrome to recognize. Turk J Emerg Med. 2021;21(2):86-89. DOI:10.4103/2452-2473.309138.
8. Gebray HM, Abeje AE, Boye AT. BRASH syndrome with a complete heart block — a case report. BMC Cardiovasc Disord. 2024;24(1):114. DOI:10.1186/s12872-024-03782-6.
9. Sattar Y, Bareeqa SB, Rauf H, et al. Bradycardia, Renal Failure, Atrioventricular-nodal Blocker, Shock, and Hyperkalemia Syndrome Diagnosis and Literature Review. Cureus. 2020;12(2):e6985. DOI:10.7759/cureus.6985.
10. Перепеч Н. Б., Михайлова И. Е. Бисопролол: фармакологические свойства и клиническое применение. РМЖ. 2004;(4):225-32.
11. Якушин C. C., Никулина Н. Н., Филиппов Е. В., и др. Результаты пилотной части госпитального регистра передозировок кардиологических лекарственных препаратов (ГРОЗА): фокус на медикаментозно обусловленную брадикардию. Российский медико-биологический вестник имени академика И. П. Павлова. 2020;28(2):153-63. DOI:10.23888/PAV-LOVJ2020282153-163.
12. Lizyness K, Dewald O. BRASH Syndrome. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024. Available from: https://www.ncbi.nlm.nih.gov/books/NBK570643/
13. Palmisano P, Accogli M, Zaccaria M, et al. Relationship between seasonal weather changes, risk of dehydration, and incidence of severe bradyarrhythmias requiring urgent temporary transvenous cardiac pacing in an elderly population. Int J Biometeorol. 2014;58(7):1513-20. DOI:10.1007/s00484-013-0755-7.
14. Фомина О. А., Переверзева К. Г. Развитие гиперкалиемии у коморбидного пациента на фоне бесконтрольного совместного применения блокаторов ренин-ангиотензиновой системы и антагонистов минералокортикоидных рецепторов. Эффективная фармакотерапия. 2023;(19):24-8. DOI:10.33978/2307-3586-2023-19-53-24-28.
15. Поселюгина О. Б., Михайлова М. И. Прогностическое значение гиперкалиемии. пути коррекции. Международный научно-исследовательский журнал. 2021;(1-3):57-60. DOI:10.23670/IRJ.2021.103.1.064.
16. Вишнева Е. М., Дядякина А. А., Потеряева Н. Э. Проблема гиперкалиемии у пациентов с хронической сердечной недостаточностью. Universum: медицина и фармакология. 2021;(5):8-11. DOI:10.32743/UniMed.2021.77.5.11615.
17. Palmer BF, Clegg DJ. Diagnosis and treatment of hyperkalemia. Cleve Clin J Med. 2017;84(12):934-942. DOI:10.3949/ccjm.84a.17056.
18. al-Khafaji M, al-Salem IH. Nifedipine induced bradycardia in a patient with autonomic neuropathy. Jpn Heart J. 1989;30(5):679-683. DOI:10.1536/ihj.30.679.
19. Taira N, Narimatsu A. Effects of nifedipine, a potent calcium antagonistic coronary vasodilator on atrioventricular conduction and blood flow in the isolated atrioventricular node preparation of the dog. Naunyn Schmiedebergs Arch Pharmacol. 1975;290(1):107-112. DOI:10.1007/BF00499993.
20. Sarkar S, Rapista N, Rout A, Chaudhary R. BRASH: Case Report and Review of Literature. Hearts. 2021;2(3):302-306. DOI:10.3390/hearts2030025.
21. Imburgio S, Johal A, Udongwo N, et al. BRASH Syndrome: A Case Report and Literature Review. Journal of Integrative Cardiology Open Access 2022:10.31487/j.jicoa.2022.03.05. DOI:10.31487/j.jicoa.2022.03.05.
22. Громов М. И., Федоров А. В., Михальчук М. А., Заев О. Э. Гиперкалиемия экстренных состояний: рекомендации по диагностике и лечению. Скорая медицинская помощь. 2015;16(2):38-43. DOI:10.24884/2072-6716-2015-16-2-38-43.
23. Shah P, Gozun M, Keitoku K, et al. Clinical characteristics of BRASH syndrome: Systematic scoping review. Eur J Intern Med. 2022;103:57-61. DOI:10.1016/j.ejim.2022.06.002.
24. Aziz EF, Javed F, Korniyenko A, et al. Mild hyperkalemia and low eGFR a tedious recipe for cardiac disaster in the elderly: an unusual reversible cause of syncope and heart block. Heart Int. 2011;6(2):e12. DOI:10.4081/hi.2011.e12.
25. Saeed S, Rajani R, Solheim E. A BRASH Diagnosis With a Timely Intervention. Curr Probl Cardiol. 2023;48(11):101984. DOI:10.1016/j.cpcardiol.2023.101984.
26. Ahee P, Crowe AV. The management of hyperkalaemia in the emergency department. J Accid Emerg Med. 2000;17(3):188-91. DOI:10.1136/emj.17.3.188.
27. Majeed H, Khan U, Khan AM, et al. BRASH Syndrome: A Systematic Review of Reported Cases. Curr Probl Cardiol. 2023;48(6):101663. DOI:10.1016/j.cpcardiol.2023.101663.
28. Vishnu VK, Jamshed N, Amrithanand VT, Thandar S. BRASH Syndrome: A Case Report. J Emerg Med. 2021;60(6):818-22. DOI:10.1016/j.jemermed.2021.01.033.
29. Ferreira JP, Butler J, Rossignol P, et al. Abnormalities of Potassium in Heart Failure: JACC State-of-the-Art Review. J Am Coll Cardiol. 2020;75(22):2836-50. DOI:10.1016/j.jacc.2020.04.021.
30. Kovesdy CP. Outcomes Associated With Potassium Abnormalities in CKD: It Is Time to Move to Clinical Trials. Am J Kidney Dis. 2023;82(3):251-3. DOI:10.1053/j.ajkd.2023.05.002.
31. Shionoiri H, Naruse M, Minamisawa K, et al. Fosinopril. Clinical pharmacokinetics and clinical potential. Clin Pharmacokinet. 1997;32(6):460-80. doi:10.2165/00003088-199732060-00003.
Об авторах
Д. Д. ШалаеваРоссия
Шалаева Дарья Дмитриевна.
Рязань
К. Г. Переверзева
Россия
Переверзева Кристина Геннадьевна.
Рязань
О. А. Фомина
Россия
Фомина Ольга Анатольевна.
Рязань
С. С. Якушин
Россия
Якушин Сергей Степанович.
Рязань
Дополнительные файлы
Рецензия
Для цитирования:
Шалаева Д.Д., Переверзева К.Г., Фомина О.А., Якушин С.С. BRASH синдром: клинический случай. Рациональная Фармакотерапия в Кардиологии. 2024;20(3):367-373. https://doi.org/10.20996/1819-6446-2024-3028. EDN: YSAYOM
For citation:
Shalaeva D.D., Pereverzeva K.G., Fomina O.A., Yakushin S.S. BRASH syndrome: а clinical case. Rational Pharmacotherapy in Cardiology. 2024;20(3):367-373. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3028. EDN: YSAYOM

















































