Перейти к:
Клинико-биохимические маркеры реактивности тромбоцитов при приеме ацетилсалициловой кислоты (в составе двойной антитромбоцитарной терапии) в подострый период инфаркта миокарда
https://doi.org/10.20996/1819-6446-2024-3037
EDN: OPRKXD
Аннотация
Цель. Исследовать маркеры, определяющие резидуальную тромбоцитарную активность в подострый период инфаркта миокарда (ИМ) при приеме ацетилсалициловой кислоты (АСК) в составе двойной антитромбоцитарной терапии.
Материал и методы. По результатам агрегометрии 405 пациентов с ИМ (79,5% мужчин и 20,5% женщин, средний возраст — 58,0 лет) были разделены на группы: 11 пациентов с низкой резидуальной тромбоцитарной активностью (группа 1), 236 пациентов с оптимальной тромбоцитарной активностью (группа 2) и 158 пациентов с высокой резидуальной тромбоцитарной активностью (ВРТА, группа 3). Все исследования выполнялись на 12-14 сутки ИМ: агрегометрия на агрегометре Multiplate (Германия) с несколькими индукторами агрегации, общий анализ крови и исследование тромбоцитарных индексов, определение содержания эндотелина-1, фактора Виллебранда, sP-селектина и растворимого лиганда CD40.
Результаты. Параметры, влияющие на значение ASPItest по данным однофакторного линейного регрессионного анализа: индекс массы тела (β=0,53, 95% ДИ 0,11-0,96; р=0,013); окружность талии (β=0,31, 95% ДИ 0,14-0,49; р=0,0004); скорость оседания эритроцитов (β=0,27, 95% ДИ 0,12-0,42; р=0,0004); количество лейкоцитов (β=1,47, 95% ДИ 0,51-2,42; р=0,0027); количество тромбоцитов (β=0,042, 95% ДИ 0,019-0,064; р=0,00025); тромбокрит (β=36,8, 95% ДИ 14,6-59,1; р=0,0012); средний объем тромбоцитов (β=1,94, 95% ДИ 0,06-3,84; р=0,043); ширина распределения тромбоцитов (β=1,36, 95% ДИ 0,22-2,51; р=0,02); креатинин (β=0,11, 95% ДИ 0,011-0,21; р=0,03); С-реактивный белок (β=0,18, 95% ДИ 0,05-0,32; р=0,007); TRAP-test (β=0,18, 95% ДИ 0,11-0,24; р=0,000001); фибриноген (β=2,6, 95% ДИ 1,17-4,02; р=0,0004). В модель бинарной логистической регрессии для расчета вероятности развития ВРТА к АСК вошли следующие факторы: количество тромбоцитов, процент объема больших тромбоцитов, содержание фибриногена, эндотелина-1 и фактора Виллебранда. При пороге отсечения по вероятности p₀=0,5412 для данной модели: чувствительность — 81,08%, специфичность — 73,21%, точность классификации — 76,34%, площадь под ROC-кривой — 0,79 (ДИ 0,696-0,883).
Заключение. На 12-14 сутки ИМ чрезмерный ответ на АСК выявлен у 2,7% пациентов; недостаточный ответ на АСК — у 39,0%. Клинико-биохимическими маркерами ВРТА к АСК в подострый период ИМ являются количество тромбоцитов, процент объема больших тромбоцитов, содержание фибриногена, эндотелина-1 и фактора Виллебранда.
Ключевые слова
Для цитирования:
Пронько Т.П., Снежицкий В.А., Копыцкий А.В. Клинико-биохимические маркеры реактивности тромбоцитов при приеме ацетилсалициловой кислоты (в составе двойной антитромбоцитарной терапии) в подострый период инфаркта миокарда. Рациональная Фармакотерапия в Кардиологии. 2024;20(6):618-624. https://doi.org/10.20996/1819-6446-2024-3037. EDN: OPRKXD
For citation:
Pronko T.P., Snezhitskiy V.A., Kapytski A.V. Platelet reactivity clinical and biochemical markers when taking acetylsalicylic acid as part of dual antiplatelet therapy in the myocardial infarction subacute period. Rational Pharmacotherapy in Cardiology. 2024;20(6):618-624. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3037. EDN: OPRKXD
Введение
Назначение длительной двойной антитромбоцитарной терапии (ДААТ) сопряжено с риском тромбоза и вероятностью кровотечения. Современные рекомендации по терапии антитромбоцитарными лекарственными средствами опираются на данные о выживаемости пациентов, однако не учитывают антитромбоцитарные эффекты препаратов из-за отсутствия лабораторного контроля их влияния на тромбоциты в проводимых исследованиях [1]. У пациентов с высокой резидуальной тромбоцитарной активностью (ВРТА) как на ацетилсалициловую кислоту (АСК), так и на клопидогрел, чаще развиваются тромбоз стента, инфаркт миокарда (ИМ), растет сердечно-сосудистая смертность, по сравнению с пациентами, чувствительными к данным препаратам [2], в то время как низкая резидуальная тромбоцитарная активность (НРТА) в период ДААТ сопряжена с повышенной частотой кровотечений [3]. Эффективность АСК зависит не только от активности циклооксигеназы 1, но также от наличия и особенностей метаболизма субстратов этого фермента, активности других клеток (лейкоцитов, эндотелиоцитов), взаимодействующих с тромбоцитами, сопутствующих заболеваний, времени, прошедшего с момента развития ИМ. Изучение частоты распространения ВРТА и НРТА к АСК у пациентов в разные сроки ИМ, и знание факторов, влияющих на их развитие, имеет большое клиническое значение. Дальнейшие исследования метаболических процессов в тромбоцитах и взаимодействующих с ними клетках, связанных с эффективностью АСК, могут привести к выявлению дополнительных механизмов ВРТА и НРТА, что будет способствовать профилактике развития связанных с ними осложнений.
Цель исследования — изучить маркеры, определяющие резидуальную тромбоцитарную активность в подострый период ИМ при приеме АСК в составе ДААТ.
Материал и методы
В зависимости от чувствительности к АСК 405 пациентов с ИМ были разделены на три группы. В группу 1 вошли пациенты с чрезмерным ответом на АСК (с НРТА) — 11 (2,7%) человек, в группу 2 — пациенты с достаточным ответом на АСК (с оптимальной тромбоцитарной активностью (ОТА)) — 236 (58,3%) человек, в группу 3 — пациенты с недостаточным ответом на АСК (с ВРТА) — 158 (39,0%) человек.
Информированное согласие на участие в исследовании было подписано каждым пациентом, включенным в исследование. АСК 75 мг/сут. (таблетки кишечнорастворимые, покрытые пленочной оболочкой) и клопидогрел 75 мг/сут. составили ДААТ. Пациенты изначально находились в Гродненском областном клиническом кардиологическом центре, в Гродненской областной клинической больнице медицинской реабилитации проводился этап реабилитации, что позволяло решить вопрос с приверженностью лечению, все назначаемые лекарственные средства принимались под контролем медицинского персонала.
Включенным в исследование пациентам на 12-14 сутки ИМ проводились все диагностические мероприятия. Общеклинические обследования, биохимический анализ крови (глюкоза, креатинин, общий холестерин, С-реактивный белок (СРБ)), общий анализ крови с определением тромбоцитарных индексов: СОТ — средний объем тромбоцита, ШРТ — ширина распределения тромбоцитов по их объему, тромбокрит — величина, отражающая процент объема тромбоцитов, ПОБТ — процент объема больших тромбоцитов (размером более 30 фл) к общему объему тромбоцитов. При помощи иммуноферментного анализа определялось содержание фактора Виллебранда, sP-селектина, эндотелина-1 и растворимого лиганда CD40 у 145 человек на анализаторе Sunrise (TECAN, Австрия), наборы тест систем Fine Biotech, Китай. Реовазографическим методом на "Импекарде-М", Беларусь определялась эндотелийзависимая вазодилатация (ЭЗВД) у 345 человек при помощи пробы с реактивной гиперемией [4]. На агрегометре Multiplate (Verum Diagnostica GmbH, Германия) исследовалась тромбоцитарная активность, ВРТА (недостаточный эффект АСК) определялась по данным ASPItest (индуктор — арахидоновая кислота) при значении площади под агрегационной кривой выше 30 U, НРТА (чрезмерный эффект АСК) — при значении площади под агрегационной кривой ниже 10 U. Для определения потенциальной агрегационной активности тромбоцитов проводился TRAP-test (индуктор пептид активатор тромбин рецепторов) [5].
Для статистического анализа использовали программу "Statsoft Statistica 10" и язык программирования "R", дополненный пакетами "pROC" и "ROCR". Описательные статистики были представлены медианой и квартильным интервалом ("Me [Q1; Q3]"), так как все количественные переменные были распределены по законам, отличным от нормального (для проверки нормальности использовался критерий Лиллиефорса). Сравнение количественных переменных между 3 группами выполнялось при помощи непараметрического критерия Краскелла–Уоллиса с последующими апостериорными попарными сравнениями по критерию Данна. Непараметрическим критерием Манна–Уитни сравнивали 2 независимые группы. Для сравнения категориальных дихотомических распределений между 3 независимыми группами использовался критерий однородности χ² Пирсона или точный критерий Фишера (ТКФ). При необходимости выполнялись последующие попарные апостериорные сравнения распределений между группами (с поправкой Бонферрони для p-значений) при помощи тех же критериев (при необходимости для таблиц 2×2 для критерия χ² Пирсона применялась поправка Йейтса). Для описания корреляционных связей между количественными переменными использовался коэффициент ранговой корреляции Rs-Спирмена. Также определялись значения β-коэффициентов (c 95% доверительными интервалами (ДИ)) соответствующих уравнений простой линейной регрессии, описывающих частное влияние независимых предикторов на непрерывную переменную "ASPItest". Также строились модели бинарной логистической регрессии для изучения совокупного влияния набора предикторов на дихотомическую зависимую переменную. Статистически значимыми различия считали при р<0,05.
Результаты
Результаты исследования пациентов с различным ответом на АСК в подострый период ИМ представлены в табл. 1. Пациенты исследуемых групп различаются по полу, частоте курения, окружности талии, количеству лейкоцитов, тромбоцитов, уровню гемоглобина, значениям тромбокрита, скорости оседания эритроцитов (СОЭ), значениям TRAP-test, содержанию СРБ и фибриногена. Попарное сравнение показателей между группами демонстрирует, что в группе 1 по сравнению с группой 2 было выше количество лейкоцитов (р=0,02), были ниже СОЭ (р=0,023) и содержание СРБ (р=0,013), по сравнению с группой 3 чаще встречались женщины (ТКФ=0,0015), была меньше окружность талии (р=0,026) и ниже содержание СРБ (р=0,0005). У пациентов группы 3 по сравнению с группой 2 был выше доля курящих лиц (ТКФ=0,05), выше количество тромбоцитов (р=0,022), значения тромбокрита (p=0,007), TRAP-test (p=0,00004), содержание СРБ (p=0,011).
При корреляционном анализе выявлены ассоциации между ASPItest и курением (Rs=0,12; р=0,017), индексом массы тела (Rs=0,1; р=0,041), окружностью талии (Rs=0,15; р=0,002), количеством лейкоцитов (Rs=0,15; р=0,0018), эритроцитов (Rs=0,13; р=0,012), тромбоцитов (Rs=0,12; р=0,021), уровнем гемоглобина (Rs=0,12; р=0,017), значениями тромбокрита (Rs=0,12; р=0,0014), ШРТ (Rs=0,16; р=0,0016), ПОБТ (Rs=0,13; р=0,025), содержанием в крови креатинина (Rs=0,11; р=0,024), СРБ (Rs=0,17; р=0,0005), фибриногена (Rs=0,18; р=0,0007) и значениями TRAP-test (Rs=0,22; р=0,000014).
Параметры, влияющие на значение ASPItest по данным однофакторного линейного регрессионного анализа: окружность талии (β=0,31, 95% ДИ 0,14-0,49; р=0,0004); индекс массы тела (β=0,53, 95% ДИ 0,11-0,96; р=0,013); СОЭ (β=0,27, 95% ДИ 0,12-0,42; р=0,0004); количество лейкоцитов (β=1,47, 95% ДИ 0,51-2,42; р=0,0027); количество тромбоцитов (β=0,042, 95% ДИ 0,019-0,064; р=0,00025); значения тромбокрита (β=36,8, 95% ДИ 14,6-59,1; р=0,0012); СОТ (β=1,94, 95% ДИ 0,06-3,84; р=0,043); ШРТ (β=1,36, 95% ДИ 0,22-2,51; р=0,02); креатинин (β=0,11, 95% ДИ 0,011-0,21; р=0,03); СРБ (β=0,18, 95% ДИ 0,05-0,32; р=0,007); TRAP-test (β=0,18, 95% ДИ 0,11-0,24; р=0,000001); фибриноген (β=2,6, 95% ДИ 1,17-4,02; р=0,0004).
Модель бинарной логистической регрессии строилась для установления вероятности развития ВРТА у пациентов в подострую стадию ИМ. Для построения модели использованы данные 93 пациентов, так как у них имелся полный набор измерений по переменным, вошедшим в модель. Данная выборка по основным параметрам (пол, возраст, сопутствующая патология, частота встречаемости ВРТА, показатели общего анализа крови и т. д.) была сопоставима с основной выборкой пациентов. Параметры модели приведены в табл. 2.
Вероятность ВРТА (p) по построенной модели определяется по формуле:
p= 1/(1 + exp (-z)),
где exp — экспонента для аргумента z; z — т. н. линейный предиктор, который определяется как (см. табл. 2)
z= -11,1723 + 0,013•v1 + 0,0935•v2 + 0,5877•v3 + 0,1241•v4 + 0,0089•v5.
Данное уравнение позволяет разделять пациентов на 2 класса: при выполнении условия p<p0 пациент классифицируется как пациент без ВРТА, при p≥p0 — как пациент с ВРТА. Указанная выше вероятность p₀ называется пороговой, и в данном случае она равна p₀=0,5412. Выбор p₀ выполнен при помощи ROC-анализа, в ходе которого было подобрано такое значение пороговой вероятности, при котором разность между чувствительностью (Se) и специфичностью (Sp) была наименьшей. При данном значении p₀ достигались следующие показатели: Se=81,08%, Sp=73,21%. ROC-кривая модели приведена на рис., площадь под данной ROC-кривой составила 0,79 (95% ДИ 0,696-0,883).
Таблица 1. Клинические и лабораторные показатели в группах с разным ответом на АСК
Показатели | Группа 1, НРТА (n=11) | Группа 2, ОТА (n=236) | Группа 3, ВРТА (n=158) | ТКФ или Критерий H Краскелла–Уоллиса, р |
Возраст, лет | 58,0 [ 52,0; 71,0] | 59,0 [ 52,0; 66,0] | 57,0 [ 51,0; 63,0] | 5,3; р=0,07 |
Мужчины / Женщины, n (٪) | 5 (45,5) / 6 (54,5)&& | 184 (78,0) / 52 (22,0) | 133 (84,2) / 25 (15,8) | 0,0081 |
Q-ИМ / не-Q-ИМ, n (٪) | 9 (81,8) / 2 (18,2) | 189 (80,1) / 47 (19,9) | 129 (81,6) / 29 (18,4) | 0,94 |
Локализация ИМ (передний / нижний и задне-базальный), n (٪) | 6 (54,5) / 5 (45,5) | 110 (46,6) / 126 (53,4) | 80 (50,6) / 78 (49,4) | 0,68 |
ФК по NYHA, n (٪) 1 2 3 | 1 (9,1) 10 (90,9) - | 45 (19,1) 160 (67,8) 31 (13,1) | 28 (17,7) 105 (66,5) 25 (15,8) | χ²=3,6; р=0,47 |
Реперфузионная терапия, n (٪) ТЛТ ТЛТ+ЧКВ ЧКВ Консервативно | 3 (27,3) 2 (18,2) 6 (54,5) - | 14 (5,9) 64 (27,1) 135 (57,2) 23 (9,8) | 13 (8,2) 33 (20,9) 101 (63,9) 11 (7,0) | χ²=10,9; р>0,05 |
АГ, n (٪) | 11 (100,0) | 227 (96,2) | 154 (97,5) | - |
Продолжительность АГ, лет | 5,0 [ 1,0; 10,0] | 5,0 [ 1,0; 14,0] | 5,0 [ 1,0; 14,0] | 0,2; р=0,9 |
Инфаркт миокарда в анамнезе, n (٪) | 1 (9,1) | 40 (17,0) | 21 (13,3) | 0,6 |
Сахарный диабет, n (٪) | 0 | 34 (14,4) | 18 (11,4) | 0,4 |
Отягощенная наследственность, n (٪) | 7 (63,6) | 129 (54,7) | 99 (62,7) | 0,27 |
Количество имплантированных стентов | 2,0 [ 1,0; 2,5] | 2,0 [ 1,0; 3,0] | 2,0 [ 1,0; 2,0] | 0,08; р=0,96 |
Курение, n (٪) | 5 (45,5) | 145 (61,4) | 116 (73,4)* | 0,015 |
Продолжительность курения, лет | 25,0 [ 25,0; 26,0] | 30,0 [ 25,0; 40,0] | 30,0 [ 20,0; 40,0] | 4,8; р=0,09 |
Количество сигарет в сутки, штук | 20,0 [ 20,0; 30,0] | 20,0 [ 15,0; 30,0] | 20,0 [ 10,0; 20,0] | 2,3; р=0,31 |
Индекс массы тела, кг/м2 | 27,7 [ 25,0; 28,9] | 27,8 [ 24,9; 31,1] | 28,1 [ 26,1; 31,1] | 2,0; р=0,36 |
Окружность талии, см | 88,0 [ 86,0; 101,0]& | 99,0 [ 91,0; 106,0] | 100,0 [ 94,0; 107,0] | 8,2; р=0,016 |
Лица с ожирением, n (٪) | 2 (18,2) | 77 (32,6) | 53 (33,5) | 0,68 |
Тропонин, нг/л | 6,0 [ 0,8; 29,2] | 3,1 [ 0,7; 10,0] | 5,9 [ 1,6; 10,0] | 1,4; р=0,49 |
Глюкоза натощак, ммоль/л | 5,3 [ 4,6; 5,8] | 5,5 [ 5,1; 6,0] | 5,5 [ 4,9; 6,1] | 2,9; р=0,23 |
Общий холестерин, ммоль/л | 4,2 [ 3,8; 5,0] | 3,7 [ 3,2; 4,5] | 3,8 [ 3,3; 4,6] | 3,2; р=0,2 |
Креатинин, мкмоль/л | 78,0 [ 76,0; 82,0] | 87,0 [ 78,0; 98,0] | 88,0 [ 79,0; 101,0] | 4,8; р=0,09 |
СКФ по формуле CKD-EPI, мл/мин/1,73 м2 | 78,0 [ 68,0; 90,0] | 79,0 [ 68,0; 90,0] | 82,0 [ 70,0; 95,0] | 1,4; р=0,49 |
Лейкоциты х109/л | 8,29 [ 6,0; 8,9] | 7,4 [ 6,3; 8,6]# | 8,0 [ 6,7; 9,7] | 7,4; р=0,025 |
Эритроциты х1012/л | 4,3 [ 4,0; 4,9] | 4,6 [ 4,2; 5,0] | 4,7 [ 4,4; 5,0] | 4,4; р=0,11 |
Гемоглобин, г/л | 131,0 [ 124,0; 149,0] | 142,0 [ 133,0; 153,0] | 146,0 [ 137,0; 154,0] | 6,4; р=0,042 |
Тромбоциты х109/л | 281,0 [ 229,0; 297,0] | 271,0 [ 227,0; 330,5] | 299,0 [ 242,0; 363,0]* | 7,9; р=0,019 |
СОТ, фл | 9,9 [ 9,4; 10,7] | 9,9 [ 9,3; 10,6] | 10,1 [ 9,4; 10,8] | 2,8; р=0,25 |
ШРТ, ٪ | 11,3 [ 9,7; 12,1] | 11,2 [10,1; 12,5] | 11,8 [ 10,5; 13,0] | 4,9; р=0,09 |
Тромбокрит, ٪ | 0,29 [ 0,25; 0,31] | 0,28 [ 0,23; 0,33] | 0,3 [ 0,26; 0,36]** | 9,3; р=0,0097 |
ПОБТ, ٪ | 26,6 [ 19,3; 30,4] | 25,6 [ 21,0; 30,4] | 26,8 [ 21,8; 32,0] | 1,9; р=0,39 |
СОЭ, мм/ч | 14,0 [ 8,0; 32,0] | 20,0 [ 13,0; 30,0]# | 24,0 [ 14,0; 36,0] | 8,8; р=0,012 |
TRAP-test, U | 110,5 [ 89,0; 120,0] | 91,0 [ 77,0; 110,0] | 104,0 [ 89,0; 121,0]**** | 19,8; р=0,0001 |
Эндотелин-1, пг/мл | 3,3 [ 2,6; 7,1] | 5,0 [ 3,7; 7,7] | 6,0 [ 3,7; 8,3] | 2,13; р=0,34 |
Фактор Виллебранда, нг/мл | 138,3 [ 125,2; 159,9] | 173,1 [ 134,6; 201,6] | 180,1 [ 140,5; 206,4] | 2,7; р=0,25 |
CD40L, пг/мл | 168,4 [ 141,4; 206,6] | 169,5 [ 139,0; 208,2] | 169,5 [ 131,3; 227,9] | 0,003; р=0,99 |
Р-селектин, нг/мл | 1,9 [ 1,2; 2,8] | 2,4 [ 1,5; 3,2] | 2,1 [ 1,6; 3,4] | 1,18; р=0,55 |
СРБ, мг/л | 1,0 [ 0,0; 3,0]&&& | 4,0 [ 2,0; 9,5]# | 6,0 [ 3,0; 11,5]* | 19,3; р=0,0001 |
Фибриноген, г/л | 4,1 [ 3,4; 4,7] | 4,6 [ 3,7; 5,5] | 5,0 [ 3,8; 5,9] | 8,7; р=0,013 |
ЭЗВД, ٪ | -11,6 [ -13,75; -5,4] | 0,18 [ -11,9; 13,7] | 0,81 [ -12,1; 14,2] | 5,7; р=0,057 |
Данные представлены как Me [Q1; Q3], если не указано иное # — статистически значимые различия между группами 1 и 2, где # — p<0,05; & — статистически значимые различия между группами НРТА — низкая резидуальная тромбоцитарная активность, ОТА — оптимальная тромбоцитарная активность, ВРТА — высокая резидуальная тромбоцитарная активность, ИМ — инфаркт миокарда, ФК по NYHA — функциональный класс по классификации | ||||
Таблица 2. Предикторы модели вероятности развития ВРТА и их характеристики
Предиктор | Оценка коэффициента | p | ОШ | 95٪ ДИ для ОШ |
Свободный член | -11,1723 | 0 | - | - |
Количество тромбоцитов (v1) | 0,013 | 0,0006 | 1,0130 | 1,0061-1,0211 |
ПОБТ (v2) | 0,0935 | 0,0069 | 1,0980 | 1,0294-1,1798 |
Фибриноген (v3) | 0,5877 | 0,002 | 1,7998 | 1,2585-2,6651 |
Эндотелин-1 (v4) | 0,1241 | 0,0207 | 1,1322 | 1,0269-1,2694 |
Фактор Виллебранда (v5) | 0,0089 | 0,0465 | 1,0089 | 1,0003-1,0180 |
ВРТА — высокая резидуальная тромбоцитарная активность, ОШ — отношение шансов, ДИ — доверительный интервал, ПОБТ — процент объёма больших тромбоцитов (размером более 30 фл) к общему объёму тромбоцитов | ||||
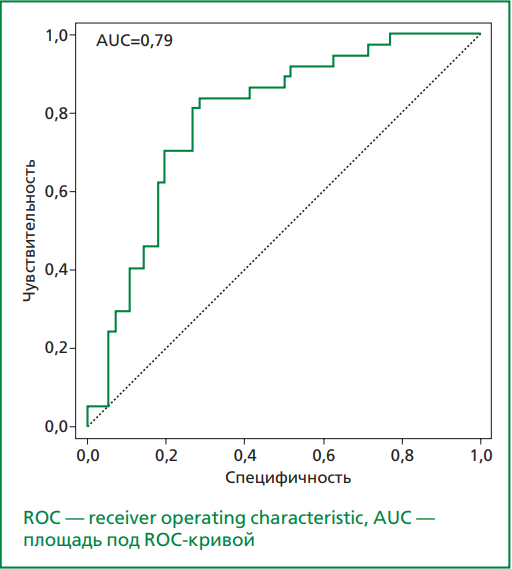
Рисунок. ROC-кривая модели.
Обсуждение
ВРТА на АСК у пациентов в подострый период ИМ встречается в 11,0-22,0% [6-8], эти данные ниже результата, полученного в настоящем исследовании — 39,0%, хотя есть работы, демонстрирующие 40,3% ВРТА на АСК [9], что согласуется с полученными результатами. Частота НРТА к АСК была невелика в исследуемой выборке и составила 2,7%. Однако при поиске в библиографических базах данных не найдены работы, посвященные частоте встречаемости НРТА на АСК у пациентов с ИМ в подострый период, получающих АСК и клопидогрел в качестве ДААТ.
Пациенты с разным ответом на АСК в подострый период ИМ различались по полу, частоте курения, окружности талии, количеству лейкоцитов, тромбоцитов, уровню гемоглобина, значениям тромбокрита, СОЭ, TRAP-test, содержанию СРБ и фибриногена. Следующие показатели: количество тромбоцитов, ПОБТ, содержание фибриногена, эндотелина-1 и фактора Виллебранда были использованы для построения модели для определения вероятности развития ВРТА на АСК. Из-за малого количества пациентов (11 человек) модель для определения НРТА не была создана.
Известно, что эндотелий сосудов, тромбоциты и ферментные системы плазмы взаимосвязаны и сопричастны в развитии тромботических осложнений [10]. Изменение количества тромбоцитов в разные периоды ИМ связано с неблагоприятным прогнозом для данной категории пациентов [11][12]. W. Stolarek и соавт. показано, что количество тромбоцитов ассоциировано с ВРТА на АСК у пациентов с ИМ [13]. Возможно, это связано с повышенным оборотом тромбоцитов в крови при ИМ [14]. По результатам настоящего исследования, у пациентов с различной эффективностью АСК было разное количество тромбоцитов в общем анализе крови, и данный параметр включен в модель определения вероятности ВРТА.
ПОБТ — один из тромбоцитарных индексов, позволяющий судить о активности и тромбогенности тромбоцитов [15]. Большие по размерам тромбоциты более реактивные и тромбогенные [15][16]. Высокие значения ПОБТ, определенные на 7 сутки ИМ, были связаны с неблагоприятным прогнозом у пациентов с ИМ, в отличие от результатов, полученных при поступлении пациентов в стационар [17]. И хотя исследования демонстрируют связь ВРТА на АСК со значениями СОТ [18], подобной связи с ПОБТ не обнаружено [19]. Согласно нашим данным, ПОБТ в группах с разным ответом на АСК был сопоставим, однако данный показатель вошел в уравнение для прогнозирования вероятности развития ВРТА.
Маркерами дисфункции эндотелия могут служить содержание эндотелина-1 и фактора Виллебранда в крови, содержание которых при повреждении эндотелиоцитов повышается [20], и эндотелиоциты становятся доступными (адгезивными) для тромбоцитов [21]. Высокое содержание эндотелина-1 в плазме рассматривается как предиктор неблагоприятного исхода у пациентов, которые перенесли ИМ [22]. Повышенные уровни агрегации тромбоцитов и эритроцитов ассоциированы с увеличением концентрации эндотелина-1 [23]. Фактор Виллебранда — один из самых больших гликопротеидов плазмы, продуцируемый клетками сосудистого эндотелия, связан как с системой гемостаза, так и с регуляцией сосудистого тонуса [24]. Фактор Виллебранда рекрутирует и активирует тромбоциты посредством взаимодействия с комплексом гликопротеиновых рецепторов тромбоцитов Ib-IX-V. Гликопротеиновые рецепторы IIb/IIIa являются точкой взаимодействия фактора Виллебранда и фибриногена [25]. Показано значительное усиление адгезии и агрегации тромбоцитов при повышенном уровне фактора Виллебранда в присутствии фибриногена, что позволяет расценивать увеличение концентраций этих факторов как один из предикторов гиперкоагуляции [26]. Согласно данным проведенного исследования, в группах с разным ответом на АСК содержание эндотелина-1 и фактора Виллебранда было сопоставимо, а содержание фибриногена статистически значимо различалось и было максимальным в подгруппе ВРТА. Более того, содержание фибриногена по данным однофакторного линейного регрессионного анализа было фактором, независимо влияющим на показатели ASPItest. Тем не менее все вышеперечисленные параметры (содержание эндотелина-1, фактора Виллебранда и фибриногена в крови) были включены в прогностическую для ВРТА модель.
Таким образом, маркерами, ассоциированными с недостаточной эффективностью АСК в подострый период ИМ, могут быть тромбоциты с повышенной реактивностью и дисфункция эндотелия. Как показывают многочисленные исследования, вариабельность ответа на АСК и другие антитромбоцитарные лекарственные средства является клинически значимым феноменом. Более широкое внедрение агрегометрии в клиническую практику может быть полезным для оптимизации ДААТ и прогнозирования серьезных неблагоприятных сердечных событий. И так как нет единых разработанных стратегий диагностики и преодоления вариабельности ответа на АСК, то врачу приходится полагаться лишь на знания факторов риска ВРТА и НРТА. Безусловно, назначать то или иное антитромбоцитарное лекарственное средство пациентам с ИМ необходимо как в соответствии с международными рекомендациями, так и с учетом индивидуальных особенностей пациента, принимая во внимание возможное развитие ВРТА и НРТА.
Ограничения исследования
Ограничениями данного исследования является одноцентровый характер, малое количество пациентов в группе с НРТА к АСК.
Заключение
У 2,7% пациентов с подострым ИМ наблюдался чрезмерный ответ на АСК, у 39,0% — недостаточный ответ. Количество тромбоцитов в общем анализе крови, ПОБТ, содержание фибриногена, эндотелина-1 и фактора Виллебранда являются клинико-биохимическими маркерами ВРТА к АСК в подострый период ИМ (Se=81,08%, Sp=73,21%).
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование: Работа выполнена при поддержке Гродненского государственного медицинского университета и ГНТП "Новые методы оказания медицинской помощи 2016-2020 годы", подпрограмма "Болезни системы кровообращения", договор 02.11/2017.
Funding: The study was supported by the Grodno State Medical University, SSTP "New methods of providing medical care 2016-2020", subprogram "Diseases of the circulatory system", agreement 02.11/2017.
Список литературы
1. Салухов В. В., Гуляев Н. И., Чепель А. И. и др. Профилактика осложнений ИБС при вариабильном тромбоцитарном ответе. Вестник Национального медико-хирургического Центра им. Н. И. Пирогова. 2020;15(4):82-90. DOI:10.25881/BPNMSC.2020.20.88.016.
2. Kukula K, Klopotowski M, Kunicki P, et al. Platelet aggregation and the risk of stent thrombosis or bleeding in elective percutaneous coronary intervention patients. Blood Coagul Fibrinolysis. 2017;28(5):383-8. DOI:10.1097/MBC.0000000000000614.
3. Čolić MD, Čalija BM, Milosavljević BM, et al. Low on-treatment platelet reactivity predicts long-term risk of bleeding after elective PCI. J Interv Cardiol. 2015;28(6):531-43. DOI:10.1111/joic.12251.
4. Воробьев А. П. Компьютерный реограф "Импекард". Методика применения. Минск; 2007.
5. Krüger JC, Meves SH, Kara K, et al. Monitoring ASA and P2Y12-specific platelet inhibition — comparison of conventional (single) and multiple electrode aggregometry. Scand J Clin Lab Invest. 2014;74(7):568-74. DOI:10.3109/00365513.2014.913305.
6. Фролова Н. С., Шахнович Р. М., Казначеева Е. М. и др. Резистентность к аспирину у больных с острым коронарным синдромом. Часть 1. Кардиоваскулярная терапия и профилактика. 2010;9(6):40-6.
7. Salama MM, Morad AR, Saleh MA, et al. Resistance to low-dose aspirin therapy among patients with acute coronary syndrome in relation to associated risk factors. J Clin Pharm Ther. 2012;37(6):630-6. DOI:10.1111/j.1365-2710.2009.01083.x.
8. Alfredsson J, Swahn E, Gustafsson KM, et al. Individual long-term variation of platelet reactivity in patients with dual antiplatelet therapy after myocardial infarction: Results from Assessing Platelet Activity in Coronary Heart Disease (APACHE). Platelets. 2019;30(5):572-8. DOI:10.1080/09537104.2018.1479519.
9. Hobikoglu GF, Norgaz T, Aksu H, et al. High frequency of aspirin resistance in patients with acute coronary syndrome. Tohoku J Exp Med. 2005;207(1):59-64. DOI:10.1620/tjem.207.59.
10. Громов А. А., Кручинина М. В., Шварц Я. Ш. и др. Система гемостаза и атерогенез. Атеросклероз. 2016;12(3):39-60.
11. Małyszczak A, Łukawska A, Dylag I, et al. Blood platelet count at hospital admission impacts long-term mortality in patients with acute coronary syndrome. Cardiology. 2020;145(3):148-54. DOI:10.1159/000505640.
12. Psarakis G, Farmakis I, Zafeiropoulos S, et al. Predictive Role of Platelet-Associated Indices on Admission and Discharge in the Long-Term Prognosis of Acute Coronary Syndrome Patients. Angiology. 2022;73(5):453-60. DOI:10.1177/00033197211052134.
13. Stolarek W, Kasprzak M, Obońska K, et al. Acetylsalicylic acid resistance risk factors in patients with myocardial infarction. Pharmacol Rep. 2015;67(5):952-8. DOI:10.1016/j.pharep.2015.02.006.
14. Лукьянец К. Ю., Пчелин И. Ю. Резистентность к терапии препаратами ацетилсалициловой кислоты: факторы риска, механизмы, методы диагностики. Juvenis Scientia. 2020;6(2):16-34. DOI:10.32415/jscientia_2020_6_2_16-34.
15. Малинова Л. И., Фурман Н. В., Долотовская П. В. и др. Тромбоцитарные индексы как маркеры интенсивности тромбоцитогенеза и агрегационной активности тромбоцитов: патофизиологическая трактовка, клиническое значение, перспективы исследования (обзор). Саратовский научно-медицинский журнал. 2017;13(4):813-20.
16. Nardin M, Verdoia M, Cao D, et al. Platelets and the Atherosclerotic Process: An Overview of New Markers of Platelet Activation and Reactivity, and Their Implications in Primary and Secondary Prevention. J Clin Med. 2023;12(18):6074. DOI:10.3390/jcm12186074.
17. Zhehestovska DV, Hrebenyk MV. Diagnostic and prognostic utility of the platelet parameters in patients with acute myocardial infarction. J Educ Health Sport. 2021;11(3):67-76. DOI:10.12775/JEHS.2021.11.03.008.
18. Kim YG, Suh JW, Yoon CH, et al. Platelet volume indices are associated with high residual platelet reactivity after antiplatelet therapy in patients undergoing percutaneous coronary intervention. J Atheroscler Thromb. 2014;21(5):445-53. DOI:10.5551/jat.20156.
19. Verdoia M, Pergolini P, Rolla R, et al; Novara Atherosclerosis Study Group (NAS). Platelet Larger Cell Ratio and High-on Treatment Platelet Reactivity During Dual Antiplatelet Therapy. Cardiovasc Drugs Ther. 2015;29(5):443-50. DOI:10.1007/s10557-015-6616-3.
20. Самолюк М. О., Григорьева Н. Ю. Оценка эндотелиальной дисфункции и возможности ее коррекции на современном этапе у больных сердечно-сосудистыми заболеваниями. Кардиология. 2019;59(3S):4-9. DOI:10.18087/cardio.2524.
21. Баринов Э. Ф., Сулаева О. Н., Прилуцкая И. А. и др. Роль и механизмы участия тромбоцитов в воспалении. Тромбоз, гемостаз и реология. 2014;(4):27-33.
22. Olivier A, Girerd N, Michel JB, et al; EPHESUS Investigators. Combined baseline and one-month changes in big endothelin-1 and brain natriuretic peptide plasma concentrations predict clinical outcomes in patients with left ventricular dysfunction after acute myocardial infarction: insights from the Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study (EPHESUS) study. Int J Cardiol. 2017;241:344-50. DOI:10.1016/j.ijcard.2017.02.018.
23. Самодова А. В., Добродеева Л. К. Соотношение содержания внеклеточного пула сигнальных молекул и активности межклеточных контактов крови в норме и патологии. Клиническая медицина. 2022;100(9-10):456-63. DOI:10.30629/0023-2149-2022-100-9-10-456-463.
24. Чернова Е. В. Фактор Виллебранда. Вестник Северо-Западного государственного медицинского университета им. И. И. Мечникова. 2018;10(4):73-80. DOI:10.17816/mechnikov201810473-80.
25. Бакунович А. В., Буланова К. Я., Лобанок Л. М. Молекулярные механизмы агрегации тромбоцитов. Журнал Белорусского государственного университета. Экология. 2017;(4):40-51.
26. Miszta A, Pelkmans L, Lindhout T, et al. Thrombin-dependent incorporation of von Willebrand factor into a fibrin network. J Biol Chem. 2014;289(52):35979-86. DOI:10.1074/jbc.M114.591677.
Об авторах
Т. П. ПронькоБеларусь
Пронько Татьяна Павловна
Гродно
В. А. Снежицкий
Беларусь
Снежицкий Виктор Александрович
Гродно
А. В. Копыцкий
Беларусь
Копыцкий Андрей Витальевич
Гродно
Дополнительные файлы
Рецензия
Для цитирования:
Пронько Т.П., Снежицкий В.А., Копыцкий А.В. Клинико-биохимические маркеры реактивности тромбоцитов при приеме ацетилсалициловой кислоты (в составе двойной антитромбоцитарной терапии) в подострый период инфаркта миокарда. Рациональная Фармакотерапия в Кардиологии. 2024;20(6):618-624. https://doi.org/10.20996/1819-6446-2024-3037. EDN: OPRKXD
For citation:
Pronko T.P., Snezhitskiy V.A., Kapytski A.V. Platelet reactivity clinical and biochemical markers when taking acetylsalicylic acid as part of dual antiplatelet therapy in the myocardial infarction subacute period. Rational Pharmacotherapy in Cardiology. 2024;20(6):618-624. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3037. EDN: OPRKXD

















































