Перейти к:
Рабдомиолиз как редкое тяжёлое осложнение терапии статинами: дифференциальный диагноз в условиях реальной клинической практики (клинический случай)
https://doi.org/10.20996/1819-6446-2025-3110
EDN: FMTXPE
Аннотация
Механизмы лекарственно-индуцированных миопатий — прямая миотоксичность, иммуноопосредованное и непрямое повреждение мышц. Клинические проявления варьируют от бессимптомных или небольших миалгий и мышечной слабости до хронической миопатии с выраженной слабостью и в редких случаях рабдомиолиза с высвобождением продуктов клеточного распада в кровоток и межклеточное пространство. Мышечные симптомы, хотя и считаются наиболее частыми нежелательными явлениями при использовании статинов, в большинстве случаев не представляют реальной угрозы. Крайне редким осложнением терапии статинами становится рабдомиолиз. Представленный случай иллюстрирует сложности, которые возникли при дифференциальном диагнозе причин рабдомиолиза у пациентки, получавшей высокую дозу статина. Необходимость широкого применения высокоинтенсивной статинотерапии, нередко сопровождающейся одновременным использованием тикагрелора и ингибиторов протонной помпы, требует осторожности в отношении безопасности лечения, особенно у пожилых пациентов.
Ключевые слова
Для цитирования:
Мелехов А.В., Борисовская С.В., Гаврилина Н.С., Гапонова И.И., Никитин И.Г., Эттингер О.А. Рабдомиолиз как редкое тяжёлое осложнение терапии статинами: дифференциальный диагноз в условиях реальной клинической практики (клинический случай). Рациональная Фармакотерапия в Кардиологии. 2025;21(2):174-181. https://doi.org/10.20996/1819-6446-2025-3110. EDN: FMTXPE
For citation:
Melekhov A.V., Borisovskaya S.V., Gavrilina N.S., Gaponova I.I., Nikitin I.G., Ettinger O.A. Rhabdomyolysis as a rare severe complication of statin therapy: differential diagnosis in real clinical practice (a clinical case). Rational Pharmacotherapy in Cardiology. 2025;21(2):174-181. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3110. EDN: FMTXPE
Введение
Лекарственно-индуцированные миопатии могут развиваться вследствие прямого повреждающего действия препаратов, которыми обладают глюкокортикоиды, статины, колхицин, противомалярийные препараты, алкоголь, кокаин, за счёт индуцированного иммунного воспаления (при приёме статинов, пеницилламина, α- и β-интерферонов, блокаторов фактора некроза альфа, ингибиторов контрольных точек, моноклональных антител). Ещё одной причиной может быть непрямое повреждение, например, на фоне ишемии при синдроме длительного сдавления у пациентов с лекарственно-индуцированной комой или лекарственно-индуцированной гипокалиемией) [1]. Клинические проявления лекарственно-индуцированных миопатий варьируют от миалгий (для которых характерны боль, ощущение напряжения и судороги в мышцах, боль в сухожилиях, с возможной мышечной слабостью, без повышения уровня креатинфосфокиназы (КФК)) до тяжёлой миопатии с прогрессирующей мышечной слабостью и атрофией мышц. Симптомы обычно более выражены в проксимальных мышечных группах, усиливаются в ночные часы и могут провоцироваться физической нагрузкой [1-3].
Мышечные симптомы — наиболее частые нежелательные явления при использовании статинов, для обозначения которых используют термины "статин-индуцированная миопатия" (СИМ) и "статин-ассоциированные мышечные симптомы". Классификация Европейского общества атеросклероза (EAS, 2015) выделяет в качестве фенотипов СИМ, помимо изолированного повышения КФК или только мышечных симптомов, миалгию (при повышении КФК в 4 раза от верхней границы нормы (ВГН)), миозит или миопатию (при повышении КФК более чем в 10 раз от ВГН), и рабдомиолиз (РМ) (повышение КФК более чем в 40 раз от ВГН при наличии почечного повреждения или миоглобинурии) [4]. СИМ обычно развивается в течение первых 4-6 нед. приёма статинов [4][5], однако есть описания и более позднего развития данного осложнения. Например, в небольшом ретроспективном наблюдательном исследовании время до появления симптомов составляло в среднем 6,3 мес., максимум — 9,8 мес. [6].
Частота СИМ, по данным рандомизированных контролируемых исследований (РКИ), колеблется в диапазоне 1,5 до 5% [7]. В крупном метаанализе РКИ, изучавшем применение разных статинов, в том числе в высоких дозах, частота РМ была крайне низкой — от 0 до 0,22%, и при этом сопоставима с плацебо [8]. В связи с редкостью РМ в литературе представлен главным образом в виде отдельных наблюдений [9][10].
Несомненно, основным фактором риска как СИМ, так и РМ, является сочетание статинов с препаратами, влияющими на их метаболизм за счёт подавления работы ферментных систем: ингибиторами протеаз, макролидами, азолами, недигидропиридиновыми блокаторами кальциевых каналов, гемфиброзилом, циклоспорином, антидепрессантами, амиодароном, фенофибратом, а также эзетимибом [5][7][9][11]. Также исследователи указывают на рост вероятности РМ с увеличением дозы статина [12].
Приводим описание случая РМ, развившегося на фоне интенсивной статинотерапии, который потребовал проведения сложного поиска причины его развития и оптимизации дальнейшего лечения.
Описание клинического случая
Пациентка Л., 83 года, 24.04.2024 госпитализирована в терапевтическое отделение "ГКБ им. В. М. Буянова" с жалобами на выраженную слабость в нижних конечностях вплоть до невозможности вставать и передвигаться, слабость в руках, боль в мышцах верхних и нижних конечностей, боль в спине, отсутствие аппетита, появление "синяков" на коже.
Длительно страдает артериальной гипертензией, получает антигипертензивную терапию, при домашнем самоконтроле последнее время артериальное давление (АД) в целевом диапазоне. С 2020 г. беспокоят ангинозные приступы, соответствующие стенокардии II функционального класса.
В декабре 2021 г. на фоне повышения АД до 170 и 100 мм рт.ст. перенесла транзиторную ишемическую атаку в вертебрально-базилярном бассейне. Во время стационарного лечения выявлены смешанная гиперлипидемия, атеросклероз брахиоцефальных артерий (БЦА) с гемодинамически значимым стенозом правой внутренней сонной артерии (ВСА) 65-70%. Выписана с рекомендациями приёма периндоприла, индапамида, ацетилсалициловой кислоты, аторвастатина 20 мг/сут. В дальнейшем самостоятельно чередовала приём аторвастатина и розувастатина в умеренных дозах.
В январе 2022 г. амбулаторно проведена компьютерная томографическая ангиография артерий шеи с контрастированием (Ультравист, 80 мл) (рис. 1). Выявлены: стенозирующий атерокальциноз БЦА. Стеноз правой ВСА 70% в шейном сегменте. Патологические извитости обеих ВСА. Гипоплазия правой позвоночной артерии в сегменте V4. Увеличение и неоднородность правой доли щитовидной железы (гиподенсный узел до 24 мм). В дальнейшем проведена тонкоигольная биопсия узла, хирургическое лечение не предлагалось.
13.03.2024 больная перенесла острый инфаркт миокарда передней стенки левого желудочка (ЛЖ) с подъёмом сегмента ST, осложнённый острой левожелудочковой недостаточностью. При коронароангиографии (контраст — Омнипак, 100 мл) выявлено многососудистое поражение коронарных артерий, выполнено чрескожное вмешательство на инфаркт-связанной артерии (ангиопластика устья передней нисходящей артерии, имплантация стента с лекарственным покрытием Resolute Integrity от устья ствола в проксимальную треть передней нисходящей артерии) (рис. 2). Пациентка выписана с рекомендациями продолжения двойной антитромбоцитарной терапии (ацетилсалициловая кислота и тикагрелор), приёма периндоприла, бисопролола, спиронолактона. Повышение интенсивности гиполипидемической терапии (розувастатин 40 мг/сут.) также было обоснованным и представлялось безопасным — уровень аминотрансфераз в норме. При выписке уровень креатинина составлял 103 мкмоль/л.
Через некоторое время после выписки больная стала отмечать прогрессирующую слабость, боль в руках и (в большей степени) ногах, появление "синяков" на теле. Ночью 22.04.2024 при попытке встать не удержалась, осела на ноги на пол из-за слабости в ногах, после чего передвигаться самостоятельно не смогла. 23.04.2024 госпитализирована в неврологическое отделение стационара с диагнозом двусторонней люмбоишиалгии. 24.04.2024 выписана по собственному желанию, обратилась в приёмное отделение "ГКБ им. В. М. Буянова".
При осмотре состояние средней тяжести. Сознание ясное. Питание удовлетворительное. Кожный покров обычной окраски, отёков нет. Множественные мелкие "отцветающие" экхимозы на коже в области левых лучезапястного и коленного суставов. Дыхание везикулярное, проводится во все отделы лёгких, хрипы не выслушиваются. Частота дыхательных движений — 17 в мин, SрO2 — 98%. Тоны сердца приглушены, ритм правильный. АД — 120/80 мм рт.ст., частота сердечных сокращений — 60 в мин. Слизистая полости рта, язык без особенностей. Живот при пальпации мягкий, безболезненный. Печень, селезёнка не пальпируются. Симптомы раздражения брюшины отрицательные. Стул без особенностей. Мочеиспускание учащено, безболезненное, хроническое недержание мочи.
В сыворотке крови значительно повышены ферменты цитолиза и КФК (>130-кратного превышения ВГН) (табл.). Повышение общей КФК >50 ВГН, сопровождавшееся высоким уровнем миоглобина — 910 мкг/л (референсные значения 10-46 мкг/л), вышеописанной клинической симптоматикой, снижением в дальнейшем темпов диуреза и скорости клубочковой фильтрации, лабораторными признаками поражения печени, позволило заподозрить РМ, вызванный приёмом статина и осложнённый развитием острого почечного повреждения (ОПП), а также лекарственный гепатит. Приём статина прекращен, пациентка переведена в отделение интенсивной терапии. Несмотря на начатую инфузионную терапию, потребовалось введение небольших доз вазопрессоров. Полиорганная недостаточность ограничивала возможности применения плазмафереза. В связи с нарастанием признаков РМ и ОПП был проведён сеанс продлённой вено-венозной гемодиафильтрации, позволивший добиться положительной динамики. В дальнейшем ОПП разрешилось, явления РМ купированы (см. табл.). Переведена в терапевтическое отделение, где постепенно восстанавливались способность к самообслуживанию и самостоятельному передвижению.
На серии электрокардиограмм синусовый ритм, отклонение электрической оси сердца влево (рис. 3).
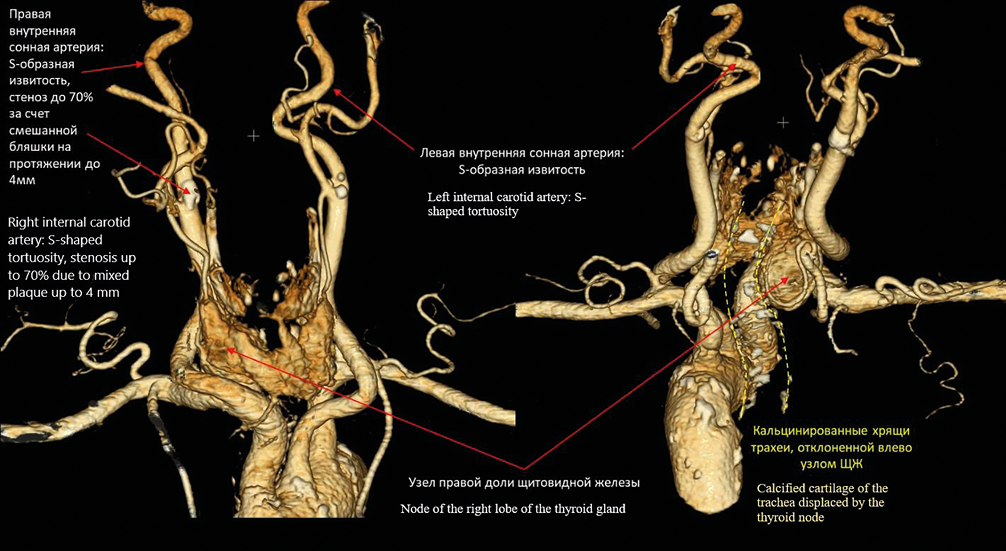
ЩЖ — щитовидная железа
Рисунок 1. КТ-ангиограмма артерий шеи.
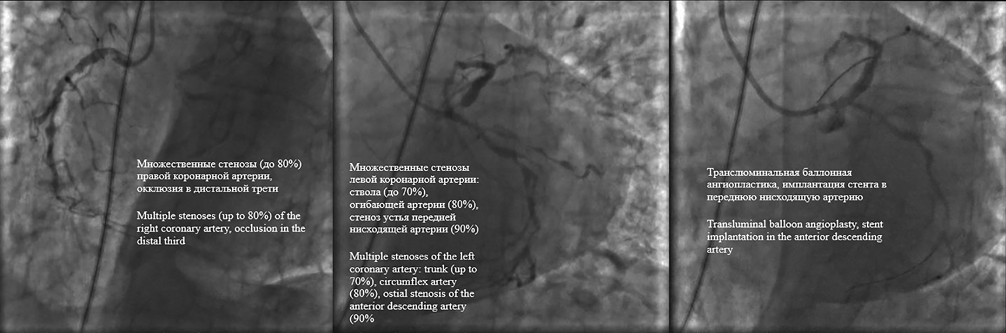
Рисунок 2. Коронарограмма: транслюминальная баллонная ангиопластика и стентирование передней нисходящей артерии.
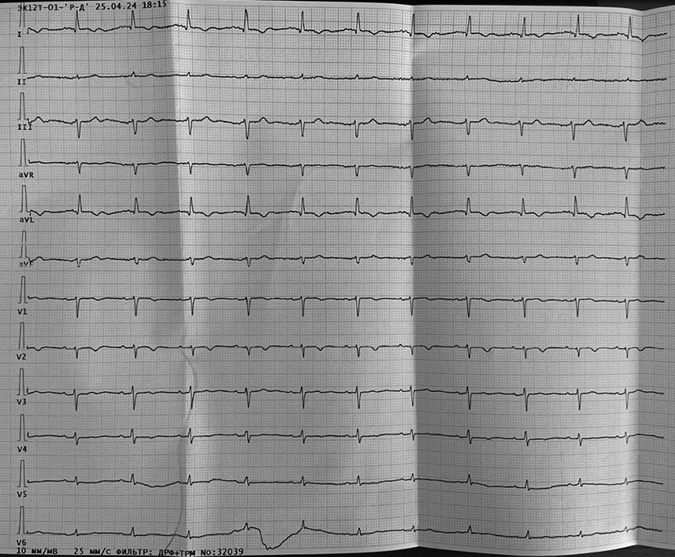
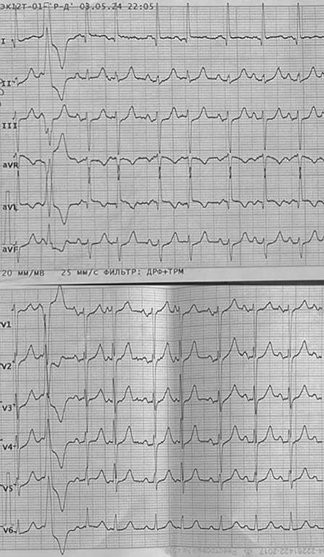
Рисунок 3. Электрокардиограммы (слева — 24.04.2024, справа — 03.05.2024).
Таблица. Динамика лабораторных показателей
Показатель | Референсные значения | 2021 г. | 2024 г. | |||||
02.12 | 13.03 | 24.04 | 26.04 | 01.05 | 08.05 | 01.07 | ||
Общий холестерин, мМоль/л | 0-5,2 | 6,6 | 4,14 | 2,9 | 6,5 | |||
ЛНП, мМоль/л | 0-2,6 | 3,4 | 2,5 | 1,4 | 4,1 | |||
ЛВП, мМоль/л | 1,03-1,55 | 1 | 1,38 | 0,67 | 1,5 | |||
Триглицериды, мМоль/л | 0-1,7 | 1,35 | 0,99 | 1,75 | 1,73 | |||
АЛТ, ЕД/л | 0-31 | 74 | 10 | 651 | 679 | 259 | 70 | |
АСТ, ЕД/л | 0-35 | 79 | 23 | 1150 | 788 | 142 | 69 | |
ГГТ, ЕД/л | 0-73 | 428 | 557 | 829 | 200 | |||
ЩФ, ЕД/л | 64-306 | 1391 | 1493 | 1827 | 567 | |||
КФК, ЕД/л | 32-294 | 57 | 39 597 | 56 342 | 2378 | 114 | 41 | |
КФК-МВ, ЕД/л | 0-25 | 2267 | 2231 | 12 | ||||
ЛДГ, ЕД/л | 225-450 | 2318 | 1632 | 842 | 484 | |||
Креатинин, мкмоль/л | 53-106 | 56 | 108 | 409 | 474 | 273 | 94 | 118 |
Калий, мМоль/л | 3,44-5,3 | 3,95 | 4,29 | 3,6 | 3,0 | 3,99 | 4,1 | |
Общий белок, г/л | 65-85 | 59 | 40 | 58 | 60 | |||
Альбумин, г/л | 35-55 | 29,1 | 30,6 | 34 | ||||
D-димер, нг/мл | 0-500 | 1738 | 3021 | |||||
Гемоглобин, г/л | 120-140 | 95 | 103 | 113 | 101 | 100 | 78 | |
Эритроциты, ×1012/л | 3,9-5,0 | 3,8 | 4,25 | 3,89 | 3,50 | 3,37 | 2,84 | |
АЛТ — аланиновая аминотрансфераза, АСТ — аспарагиновая аминотрансфераза, ГГТ — гамма-глютамилтранспептидаза, КФК — креатинфосфокиназа, КФК-МВ — креатинфосфокиназа, MB фракция, ЛВП — липопротеиды высокой плотности, ЛДГ — лактатдегидрогеназа, ЛНП — липопротеиды низкой плотности, ЩФ — щелочная фосфатаза | ||||||||
При ультразвуковом исследовании брюшной полости и почек дилатации чашечно-лоханочной системы не выявлено, размеры почек нормальные, диффузные изменения печени.
По данным эхокардиографии выявлены: дилатация левого предсердия (индексированный объём — 34 мл/м2), локальная и глобальная систолическая функция сохранена, фракция выброса ЛЖ — 58%, концентрическая гипертрофия ЛЖ (толщина межжелудочковой перегородки — 1,6 см, задней стенки ЛЖ — 1,2 см, конечный диастолический размер ЛЖ — 4,7 см), 1 степень нарушения диастолической функции ЛЖ. Выраженное повышение концентрации N-концевого промозгового натрийуретического пептида (5221,0 пг/мл), а также тропонина I — 0,185-0,175 мкг/л (норма (N) 0,008-0,029) скорее отражало почечную дисфункцию, чем объёмную или прессорную перегрузку ЛЖ.
Помимо известного атеросклеротического поражения БЦА, при ультразвуковом исследовании у пациентки выявлены: стеноз поверхностной бедренной артерии справа (60-65%), окклюзии поверхностной бедренной артерии слева и обеих большеберцовых артерий без клинических признаков ишемии.
Последовательно исключены альтернативные причины развившегося РМ. Пациентка отрицала чрезмерную физическую нагрузку, травмы, перегрев или переохлаждение, приём грейпфрутового или гранатового соков, препаратов солодки, наркотических веществ, алкоголя, наркотиков, а также значимо влияющих на метаболизм статинов препаратов. При поступлении признаков вирусной или бактериальной инфекции, локальных очагов воспаления не было. У пациентки показатели калия, магния, гликемии были в пределах референсных значений, отсутствовали глюкозурия и кетонурия, она имела эутиреоидный статус.
Исследование антинуклеарных антител (антинуклеарный фактор), антител к топоизомеразе 1 (Scl-70), двуспиральной ДНК (иммуноглобулин G), Jo-1, нуклеосомам, гистонам (H1, H2A, H2B, H3, H4), митохондриям, RNP/SM, рибосомальному белку P-RiboP, PM-Scl, Sm-антигену, SS-A60, SS-A52, SS-B (La) позволило исключить системные заболевания соединительной ткани, в т.ч. полимиозит.
Уровень 25-OH-кальциферола у пациентки соответствовал выраженному дефициту (6,70 нг/мл, N 30-100), концентрация ионизированного кальция — 1,19 мМоль/л (N 1,13-1,3), общего фосфора — 2,50 мМоль/л (N 0,78-1,65), паратгормона — 58,30 пг/мл (N 15,00-68,30). Заместительная терапия холекальциферолом была рекомендована в дальнейшем под контролем содержания витамина D в сыворотке крови.
Также известно, что в 2021 г. у пациентки идентифицированы атрофический пангастрит и язвенный колит, по поводу которых она длительно получала ингибиторы протонной помпы (ИПП) и месалазин. По-видимому, эти заболевания стали основой для развития гипохромной нормоцитарной анемии лёгкой степени со сниженными уровнями сывороточного железа и цианкобаламина, в связи с чем периодически назначались пероральные препараты железа и цианкобаламина. В сентябре 2023 г. при контрольных исследованиях изменения сохранялись, также были выявлены хронические эрозии желудка. За время пребывания в "ГКБ им. В. М. Буянова" диспептических жалоб, нарушений стула не было, отсутствовали токсины Clostridium difficile в кале. В связи с необходимостью дальнейшего применения ацетилсалициловой кислоты приём ИПП продолжен.
Для оценки связи мышечных симптомов с приёмом статинов использованы критерии Национальной ассоциации липидологов (National Lipid Association, США) [13], в данном случае связь мышечных симптомов с приёмом статинов может рассматриваться как "возможная" (имеется типичное симметричное поражение мышц бёдер, дебют симптомов <4 нед. от интенсификации терапии статинами, уменьшение боли через <2 нед. после отмены препарата), поскольку по этическим соображениям авторы статьи не могли оценить возврат симптомов после возобновления использования статинов (чтобы связь стала "вероятной"). Несмотря на очень высокий сердечно-сосудистый риск и абсолютные показания к высокоинтенсивной терапии статинами, учитывая развитие РМ и существование альтернативных возможностей гиполипидемической терапии, в соответствии с клиническими рекомендациями решено начать терапию эзетимибом [13][14].
Пациентка выписана в удовлетворительном состоянии с диагнозом:
Основное заболевание: ишемическая болезнь сердца: постинфарктный кардиосклероз (острый инфаркт миокарда с подъёмом сегмента от 13.03.2024). Коронароангиография, чрескожное вмешательство: транслюминальная баллонная ангиопластика и стентирование устья передней нисходящей артерии (1 стент DES Resoue 3,5×12 мм) от 13.03.2024. Фоновое заболевание: гипертоническая болезнь III стадии. Целевой уровень АД достигнут. Риск 4 (очень высокий).
Осложнения: рабдомиолиз, ассоциированный с приёмом статинов. Лекарственный гепатит высокой степени активности по уровню трансаминаз. ОПП 3 степени по критериям стадирования ОПП (KDIGO). Гемодиафильтрация 27.04.2024. Хроническая сердечная недостаточность с фракцией выброса ЛЖ 1 степени. Гипопротеинемия, гипоальбуминемия. Анемия хронического заболевания лёгкой степени.
Сопутствующие заболевания: цереброваскулярная болезнь. Атеросклероз БЦА. Атеросклероз артерий нижних конечностей. Язвенный колит, ремиссия.
Уровень креатинина при выписке составил 94 мкмоль/л. Через 3 нед. после выписки (14.05.2024) при телефонном контакте пациентка сообщила о хорошем самочувствии, полном восстановлении физической активности. Уровень креатинина составлял 118 мкмоль/л, остальные лабораторные параметры в пределах нормы, однако целевых показателей липидного спектра на фоне терапии эзетимибом достичь не удалось, в связи с чем решено добавить ингибитор пропротеиновой конвертазы субтилизин-кексин типа 9.
В связи с тяжестью развившейся миопатии исследованы однонуклеотидные полиморфизмы генов, связанных с метаболизмом статинов и риском развития СИМ [15]: rs4149056, rs11045819, rs2306283 (ген SLCO1B1), rs2231142 (ген ABCG2), rs1799853, rs1057910 (ген CYP2C9) у пациентки, а также у её родной сестры, поскольку последнюю на фоне приёма аторвастатина (10 мг/сут) беспокоила слабость. У пациентки Л. выявлен генотип rs1128503-AG (ABCB1), у её сестры — rs1128503-AA, и rs1045642-AA (ABCB3) у обеих. Уровни активности белков-переносчиков SLCO1B1, ABCG2 и фермента CYP2C9, обеспечивающих нормальный метаболизм статинов, у сестёр были нормальными.
Обсуждение
При достаточно высокой частоте "мышечных" жалоб у пациентов, принимающих статины, частота истинного миозита и тем более РМ, достаточно мала. Тем неожиданней может стать тяжесть и скорость его развития, как и произошло с пациенткой, клиническое наблюдение которой представлено в статье. Необходимо отметить, что розувастатин не является самым частым "виновником" развития данного осложнения. Так, в сравнительном фармакоэпидемиологическом исследовании с использованием базы данных по фармаконадзору VigiBase® (с 1995 по 2022 гг.) в отношении риска РМ (всего 10 657 сообщений) розувастатин был на третьем месте (1777 случаев) после симвастатина и аторвастатина [16].
Выбор высокоинтенсивной монотерапии статинами сделан в соответствие с действующими клиническими рекомендациями, одобренными Научно-практическим советом Минздрава России "Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы" (срок действия 2024-2026, https://cr.minzdrav.gov.ru/preview-cr/157_5), где данная рекомендация имеет уровень доказательности Европейского общества кардиологов (ЕОК) Iа [17]. На тот момент комбинированную терапию не рассматривали, поскольку пациентка получала более низкие дозы статинов, и, кроме того, рекомендация дополнительного назначения эзетимиба имеет уровень доказательности ЕОК IIbB (польза лечения установлена менее убедительно; данные получены по результатам одного рандомизированного исследования, в данном случае — IMPROVE-IT) [18].
Ввиду характерного поражения проксимальных мышечных групп в первую очередь проводили дифференциальный диагноз с идиопатическими воспалительными миопатиями и нервно-мышечными заболеваниями. Существуют иммуноопосредованные формы статин-ассоциированной миопатии, в частности, статин-индуцированная некротизирующая аутоиммунная миопатия (СИНАМ), которая, надо отметить, встречается редко. При СИНАМ отмена статина не приводит к улучшению, так как у большинства пациентов выявляются антитела против 3-гидрокси-3-метилглютарил-кофермент А редуктаза (ГМГ-КоА-редуктазы) и анти-SRP (signal recognition particle, сигнал-узнающая частица) антитела [19]. В представленном случае отмена препарата привела к быстрому регрессу мышечной симптоматики.
В консенсусе National Lipid Association для диагностики СИМ рекомендованы, помимо оценки мышечных симптомов, уровня КФК, миоглобинурии при значительном повышении КФК (>50 ВГН), опросников для оценки боли, также силовые, аэробные тесты, оценка метаболизма, фармакогенетические исследования, биопсия мышцы [20]. Вместе с тем существует мнение, что результаты электрофизиологических исследований и данных биопсии мышц при СИМ неспецифичны, хотя имеют значение при её аутоиммунной природе [3][8]. Поскольку симптомы разрешились на фоне отмены статина, это позволило рассматривать их как проявление СИМ без проведения дополнительных исследований.
Из факторов риска СИМ [5][7][9][11] в данном случае имели место женский пол, пожилой возраст и дефицит витамина D. В нескольких нерандомизированных клинических исследованиях частота СИМ среди пациентов, получавших витамин D, была ниже [21]. Данные же о влиянии дефицита витамина D на действие статинов противоречивы [20]. Замещение дефицита витамина D у пожилой пациентки представляется, несомненно, обоснованным и необходимым.
Из принимаемых пациенткой лекарственных препаратов в фокусе внимания авторов, прежде всего, оказался тикагрелор. Среди возможных механизмов взаимодействия его со статинами рассматривают: неблагоприятное влияние тикагрелора на почечную функцию, что может снижать элиминацию статинов; конкуренцию препаратов на уровне транспортеров (полипептидный транспортер органических анионов 1B1, P-гликопротеин, ABCG2, MRP2); полиморфизм генов, кодирующих метаболические ферменты (система цитохрома P450, UDP-глюкуронозилтрансфераза и транспортеры лекарств) [22]. CYP3A4 является основным изоферментом, отвечающим за метаболизм тикагрелора и формирование его активного метаболита, при этом тикагрелор является слабым ингибитором как CYP3A4, так и Р-гликопротеина. Розувастатин в основном метаболизируется ферментом CYP2C9 с незначительным участием CYP2C19, CYP3A4 и CYP2D6, то есть он имеет низкий риск лекарственного взаимодействия с азолами, макролидами, ингибиторами протеаз, трициклическими антидепрессантами, амиодароном и варфарином [23]. Тем не менее, авторы данного наблюдения посчитали более безопасным замену тикагрелора на клопидогрел.
Известного межлекарственного взаимодействия месалазина и статинов не описано. Среди редких побочных действий ИПП (включающих почечное повреждение, переломы костей и клостридиальный колит) рассматривается и РМ, хотя некоторые работы не подтверждают связь его развития с использованием ИПП [24]. В связи с риском осложнений на фоне приёма ацетилсалициловой кислоты решено продолжить лечение ИПП.
Согласно данным литературы, выявленный у пациентки Л. генотип rs1128503-AG ассоциирован с повышением риска СИМ и лекарственного поражения печени, а rs1045642-АА (у пациентки и её сестры) — с повышением риска миалгии и СИМ, но эта связь установлена только в отношении аторвастатина [25][26].
Таким образом, развитие РМ у пожилой пациентки c определённой генетической предрасположенностью к СИМ обусловлено сочетанием абсолютно показанной высокоинтенсивной статинотерапии и двойной антитромбоцитарной терапии, включавшей тикагрелор. Определённый вклад могли иметь изменения фармакокинетики лекарств в результате воспалительного поражения кишечника, длительное использование ИПП, а также дефицит витамина D.
Заключение
Представленный случай иллюстрирует сложности, возникающие при дифференциальном диагнозе причин РМ — редкого осложнения терапии статинами. Необходимость широкого применения высокоинтенсивной статинотерапии, часто сопровождающейся одновременным использованием тикагрелора и ИПП, требует осторожности в отношении безопасности лечения, особенно у пожилых пациентов.
Список литературы
1. Ostrowski P, Bonczar M, Avram AE, et al. Safety monitoring of drug-induced muscle injury and rhabdomyolysis: a biomarker-guided approach for clinical practice and drug trials. Clin Chem Lab Med. 2023;61(10):1688-99. DOI:10.1515/cclm-2023-0313.
2. Mastaglia FL. The changing spectrum of drug-induced myopathies. Acta Myol. 2020;39(4):283-8. DOI:10.36185/2532-1900-031.
3. Janssen L, Allard NAE, Saris CGJ, et al. Muscle toxicity of drugs: when drugs turn physiology into pathophysiology. Physiol Rev. 2020;100(2):633-72. DOI:10.1152/physrev.00002.2019.
4. Stroes ES, Thompson PD, Corsini A, et al.; European Atherosclerosis Society Consensus Panel. Statin-associated muscle symptoms: impact on statin therapyEuropean Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management. Eur Heart J. 2015;36(17):1012-22. DOI:10.1093/eurheartj/ehv043.
5. Дядык А.И., Куглер Т. Е., Зборовский С.Р., Сулиман Ю.В. Статин-ассоциированные мышечные симптомы: эпидемиология, факторы риска, механизмы развития и лечебная тактика. Кардиология. 2019;59(5S):4-12. DOI:10.18087/cardio.2522.
6. Hansen KE, Hildebrand JP, Ferguson EE, Stein JH. Outcomes in 45 patients with statin-associated myopathy. Arch Intern Med. 2005;165(22):2671-6. DOI:10.1001/archinte.165.22.2671.
7. Vinci P, Panizon E, Tosoni LM, et al. Statin-Associated Myopathy: Emphasis on Mechanisms and Targeted Therapy. Int J Mol Sci. 2021;22(21):11687. DOI:10.3390/ijms222111687.
8. Davis JW, Weller SC. Intensity of statin therapy and muscle symptoms: a network meta-analysis of 153000 patients. BMJ Open. 2021;11(6):e043714. DOI:10.1136/bmjopen-2020-043714.
9. Сумароков А.Б., Чубыкина У.В., Ежов М.В. Рабдомиолиз — редкое осложнение при лечении статинами. Клиническое наблюдение и обзор литературы. Кардиологический вестник. 2022;17(1):84-92. DOI:10.17116/Cardiobulletin20221701184.
10. Цыганкова О.В., Евдокимова Н. Е., Байрамова С.С., Сусеков А.В. Статинассоциированный рабдомиолиз у женщины 60 лет с декомпенсированным сахарным диабетом 2 типа. Российский кардиологический журнал. 2021;26(11):4471. DOI:10.15829/1560-4071-2021-4471.
11. Сычев Д.А., Остроумова Т.М., Остроумова О.Д. и др. Статин-индуцированная миопатия. Безопасность и риск фармакотерапии. 2023;11(3):252-70. DOI:10.30895/2312-7821-2023-11-3-252-270.
12. Newman CB, Preiss D, Tobert JA, et al.; American Heart Association Clinical Lipidology, Lipoprotein, Metabolism and Thrombosis Committee, a Joint Committee of the Council on Atherosclerosis, Thrombosis and Vascular Biology and Council on Lifestyle and Cardiometabolic Health; Council on Cardiovascular Disease in the Young; Council on Clinical Cardiology; and Stroke Council. Statin safety and associated adverse events: a scientific statement from the American Heart Association. Arterioscler Thromb Vasc Biol. 2019;39(2):e38-e81. DOI:10.1161/ATV.0000000000000073.
13. Сумароков А.Б. Аутоиммунная некротизирующая статин-индуцированная миопатия. Атеросклероз и дислипидемии. 2022;(2):5-9. DOI:10.34687/2219-8202.JAD.2022.02.0001.
14. Ежов М.В., Кухарчук В.В., Сергиенко И.В. и др. Нарушения липидного обмена. Клинические рекомендации 2023. Российский кардиологический журнал. 2023;28(5):5471. DOI:10.15829/1560-4071-2023-5471.
15. Cooper-DeHoff RM, Niemi M, Ramsey LB, et al. The Clinical Pharmacogenetics Implementation Consortium Guideline for SLCO1B1, ABCG2, and CYP2C9 genotypes and Statin-Associated Musculoskeletal Symptoms. Clin Pharmacol Ther. 2022;111(5):1007-21. DOI:10.1002/cpt.2557.
16. Montastruc JL. Rhabdomyolysis and statins: A pharmacovigilance comparative study between statins. Br J Clin Pharmacol. 2023;89(8):2636-8. DOI:10.1111/bcp.15757.
17. Аверков О.В., Арутюнян Г.К., Дупляков Д.В. и др. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2024. Российский кардиологический журнал. 2025;30(3):6306. DOI:10.15829/1560-4071-2025-6306.
18. Cannon CP, Blazing MA, Giugliano RP, et al. IMPROVE-IT Investigators. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med. 2015;372(25):2387-97. DOI:10.1056/NEJMoa1410489.
19. Rosenson RS, Baker SK, Jacobson TA, et al., The National Lipid Association’s Muscle Safety Expert Panel. An assessment by the Statin Muscle Safety Task Force: 2014 update. J Clin Lipidol. 2014;8(3):S58-S71. DOI:10.1016/j.jacl.2014.03.004.
20. Banach M, Rizzo M, Toth PP, et al. Statin intolerance — an attempt at a unified definition. Position paper from an International Lipid Expert Panel. Expert Opin Drug Saf. 2015;14(6):935-55. DOI:10.1517/14740338.2015.1039980.
21. Glueck CJ, Lee K, Prince M, et al. Low serum vitamin D, statin associated muscle symptoms, vitamin D supplementation. Atherosclerosis. 2017;256:125-7. DOI:10.1016/j.atherosclerosis.2016.11.027.
22. Roule V, Alexandre J, Lemaitre A, et al. Rhabdomyolysis with Co-Administration of Statins and Antiplatelet Therapies-Analysis of the WHO Pharmacovigilance Database. Cardiovasc Drugs Ther. 2024;38(6):1191-9. DOI:10.1007/s10557-023-07459-8.
23. Bellosta S, Corsini A. Statin drug interactions and related adverse reactions. Expert Opin Drug Saf. 2012;11(6):933-46. DOI:10.1517/14740338.2012.712959.
24. Ohyama K, Iida M, Akiyama S, et al. Time-to-onset Analysis of Rhabdomyolysis due to Different Proton Pump Inhibitors Using a Pharmacovigilance Database. In Vivo. 2024;38(3):1285-91. DOI:10.21873/invivo.13567.
25. Lalatović N, Ždralević M, Antunović T, Pantović S. Genetic polymorphisms in ABCB1 are correlated with the increased risk of atorvastatin-induced muscle side effects: a cross-sectional study. Sci Rep. 2023;13(1):17895. DOI:10.1038/s41598-023-44792-2.
26. Hoenig MR, Walker PJ, Gurnsey C, et al. The C3435T polymorphism in ABCB1 influences atorvastatin efficacy and muscle symptoms in a high-risk vascular cohort. J Clin Lipidol. 2011;5(2):91-6. DOI:10.1016/j.jacl.2011.01.001.
Об авторах
А. В.. МелеховРоссия
Мелехов Александр Всеволодович, д.м.н., профессор кафедры госпитальной терапии им. Г.И.Сторожакова лечебного факультета (Института клинической медицины)
Москва
С. В. Борисовская
Россия
Борисовская Светлана Васильевна, к.м.н., заведующая терапевтическим отделением, доцент кафедры госпитальной терапии им. Г.И.Сторожакова лечебного факультета (Института клинической медицины)
Москва
Н. С. Гаврилина
Россия
Гаврилина Наталия Сергеевна, к.м.н., врач-терапевт терапевтического отделения №1 ГКБ им. В.М.Буянова Департамента Здравоохранения города Москвы, ассистент кафедры госпитальной терапии им. Г.И.Сторожакова лечебного факультета (Института клинической медицины)
Москва
И. И. Гапонова
Россия
Гапонова Ирина Игоревна, м.н.с. лаборатории молекулярных методов изучения генетических полиморфизмов
Москва
И. Г. Никитин
Россия
Никитин Игорь Геннадиевич, д.м.н., профессор, заведующий кафедрой госпитальной терапии им. Г.И.Сторожакова лечебного факультета (Института клинической медицины)
Москва
О. А. Эттингер
Россия
Эттингер Ольга Александровна, к.м.н., доцент кафедры госпитальной терапии им. Г.И.Сторожакова лечебного факультета (Института клинической медицины)
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Мелехов А.В., Борисовская С.В., Гаврилина Н.С., Гапонова И.И., Никитин И.Г., Эттингер О.А. Рабдомиолиз как редкое тяжёлое осложнение терапии статинами: дифференциальный диагноз в условиях реальной клинической практики (клинический случай). Рациональная Фармакотерапия в Кардиологии. 2025;21(2):174-181. https://doi.org/10.20996/1819-6446-2025-3110. EDN: FMTXPE
For citation:
Melekhov A.V., Borisovskaya S.V., Gavrilina N.S., Gaponova I.I., Nikitin I.G., Ettinger O.A. Rhabdomyolysis as a rare severe complication of statin therapy: differential diagnosis in real clinical practice (a clinical case). Rational Pharmacotherapy in Cardiology. 2025;21(2):174-181. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3110. EDN: FMTXPE

















































