Перейти к:
Диагностическая ценность моделей предтестовой вероятности Европейского общества кардиологов 2019 г. и консорциума Coronary Artery Disease в оценке обструктивной ишемической болезни сердца
https://doi.org/10.20996/1819-6446-2025-3127
EDN: FLGXNG
Аннотация
Цель. Оценить и сравнить диагностическую эффективность модели предтестовой вероятности (ПТВ) Европейского общества кардиологов (ЕОК) 2019 г. с вариантами базовой и клинической модели консорциума Coronary Artery Disease (CAD) в предсказании обструктивной ишемической болезни сердца (ИБС).
Материал и методы. В одномоментное исследование включены 366 пациентов (средний возраст — 64,8 года, мужчин — 62,6%) с подозрением на стабильную стенокардию, которым была выполнена компьютерная томографическая ангиография коронарных артерий сердца. Обструктивная ИБС определялась при наличии стеноза ≥50% в сегментах эпикардиальных коронарных артерий диаметром ≥2,5 мм. Оценивали клинические характеристики и сердечно-сосудистые факторы риска. Значения ПТВ вычисляли для каждой из трех моделей, а их диагностическую эффективность оценивали с использованием площади под ROC-кривой (AUC, area under the curve) и теста Хосмера—Лемешоу для калибровки. Также проанализированы чувствительность, специфичность и прогностическая ценность.
Результаты. Обструктивная ИБС выявлена у 270 (73,8%) пациентов, среди которых мужской пол, артериальная гипертензия, дислипидемия, курение, типичная и атипичная стенокардия встречались статистически значимо чаще (все p<0,05). Клиническая модель консорциума CAD обеспечила наиболее точную оценку распространённости обструктивной ИБС у пациентов высокого риска (76,6% ожидаемых vs 84,4% подтверждённых случаев), в то время как модель 2019 ПТВ ЕОК была более точна в группе низкого риска (2,5% ожидаемых vs 0,4% подтверждённых случаев). Клиническая модель консорциума CAD продемонстрировала лучшую предсказательную диагностическую ценность с AUC 0,760 и хорошей калибровкой (тест Хосмера—Лемешоу, p=0,823). Базовая модель консорциума CAD (AUC=0,755) заняла промежуточное место, а модель 2019 ПТВ ЕОК продемонстрировала наименьшую предсказательную ценность (AUC=0,701, плохая калибровка, p=0,001). Клиническая модель консорциума CAD с пороговым значением >33% имела чувствительность 66,7%, специфичность — 79,2%, положительная прогностическая ценность — 90% и отрицательная прогностическая ценность — 45,8% для предсказания обструктивной ИБС.
Заключение. Клиническая модель консорциума CAD продемонстрировала наиболее высокую точность в предсказании обструктивной ИБС у пациентов со стабильной стенокардией, особенно в группе высокого риска, по сравнению с моделью 2019 ПТВ ЕОК и базовой моделью консорциума CAD. Высокая диагностическая ценность и надежная калибровка делают её наиболее предпочтительным инструментом для оценки риска обструктивной ИБС.
Ключевые слова
Для цитирования:
Хоанг Ч.Х., До Д.В., Нгуен Т.Л., Майсков В.В., Кобалава Ж.Д. Диагностическая ценность моделей предтестовой вероятности Европейского общества кардиологов 2019 г. и консорциума Coronary Artery Disease в оценке обструктивной ишемической болезни сердца. Рациональная Фармакотерапия в Кардиологии. 2025;21(2):98-107. https://doi.org/10.20996/1819-6446-2025-3127. EDN: FLGXNG
For citation:
Hoang H.T., Do D.V., Nguyen T.L., Maiskov V.V., Kobalava Z.D. Diagnostic performance of the 2019 ESC pre-test probability and Coronary Artery Disease consortium models in estimating obstructive coronary artery disease. Rational Pharmacotherapy in Cardiology. 2025;21(2):98-107. https://doi.org/10.20996/1819-6446-2025-3127. EDN: FLGXNG
Введение
Ишемическая болезнь сердца (ИБС) — одна из ведущих причин смерти и заболеваемости в мире [1], приводящая к 9,1 млн смертей ежегодно [2]. Самым распространённым клиническим проявлением стабильной ИБС считается стенокардия напряжения [3]. Определение предтестовой вероятности (ПТВ) признано наиболее чувствительным методом при обследовании пациентов с подозрением на ИБС и критически важным этапом для выбора правильной тактики в диагностическом поиске [4-6].
Долгие годы в профессиональном сообществе для этой цели широко применяли модель Diamond-Forrester, рекомендуемую Американской коллегией кардиологов/Американской кардиологической ассоциацией (АКК/АКА) и Европейским обществом кардиологов (ЕОК) [6][7]. Однако недавние европейские исследования продемонстрировали, что модель Diamond-Forrester переоценивает вероятность ИБС, особенно у женщин и пациентов низкого риска [8][9], что приводит к необоснованному назначению инвазивных диагностических тестов.
Чтобы устранить эти ограничения, в клинических рекомендациях ЕОК 2019 г. по диагностике и лечению хронического коронарного синдрома предложена обновлённая модель ПТВ (2019 ПТВ ЕОК), которая дополнительно включает симптом одышки наряду с возрастом, полом и детализацией характера болевого синдрома [10]. Параллельно с этим в рекомендации включена обновлённая версия модели консорциума CAD (Coronary Artery Disease), основанная на объединённых данных крупных когортных исследований [10][11]. Эта модель представлена в двух вариантах: базовом, который учитывает возраст, пол и типичные характеристики боли в груди, но не включает симптом одышки, и клиническом, который дополнительно учитывает традиционные сердечно-сосудистые факторы риска, такие как артериальная гипертензия, сахарный диабет, дислипидемия и курение.
Недавние исследования показали, что модели консорциума CAD, в частности клиническая версия, обладают большей предсказательной ценностью по отношению к обструктивной ИБС, особенно с использованием компьютерной томографической коронарной ангиографии (ККТА) [12][13]. Тем не менее прямые сравнительные данные об эффективности моделей ПТВ консорциума CAD и ЕОК 2019 г. в клинической практике остаются ограниченными. В связи с этим цель исследования — оценить диагностическую точность базовой и клинической моделей консорциума CAD в прогнозировании обструктивной ИБС и сравнить их с моделью 2019 ПТВ ЕОК у пациентов со стабильной стенокардией.
Материал и методы
Дизайн исследования и популяция
Выполнено одномоментное описательное исследование, проведённое с декабря 2023 г. по май 2024 г. в Кардиологической больнице Там Дык, г. Хошимин, Вьетнам. В исследование были последовательно включены все пациенты в возрасте 18 лет и старше, с документированной стабильной стенокардией напряжения и известными результатами ККТА. Стабильную стенокардию определяли в соответствии с актуальными клиническими рекомендациями [10][14], классифицируя боль в груди на три типа: типичная стенокардия, атипичная стенокардия и неангиозная боль в груди. Пациенты с типичной стенокардией описывали все три характеристики боли:
- сжимающую боль или ощущение тяжести в груди с типичной продолжительностью болевого синдрома;
- боль в груди, вызванную физической нагрузкой или эмоциональным стрессом;
- облегчение симптомов стенокардии в течение нескольких минут после отдыха или приёма нитроглицерина под язык.
Пациенты с атипичной стенокардией применяли для описания болевого синдрома только два из трех критериев, тогда как у пациентов с неангиозной болью в груди наблюдали один из критериев.
Пациентов не включали в исследование, если у них подозревали острый коронарный синдром, в анамнезе был инфаркт миокарда или коронарная реваскуляризация, имели повышение температуры тела, декомпенсацию хронической сердечной недостаточности, терминальную стадию печеночной или почечной недостаточности. Кроме того, в исследование не включали пациентов с психическими расстройствами, которые мешали им отвечать на вопросы исследователей, и пациенты с неинформативными данными ККТА. Исследование проводилось в соответствии с Хельсинкской декларацией и было одобрено этическим комитетом Медицинского университета Фам Нгок Тхач (номер одобрения 959/TDHYKPNT-HDDD, дата 19 декабря 2023 г.). Все участники давали информированное согласие перед включением в исследование.
Сбор данных
На этапе включения проанализированы демографические и клинические данные пациентов, включая сердечно-сосудистый риск и результаты ККТА. ПТВ ИБС рассчитывали с использованием трех моделей: 2019 ПТВ ЕОК [10], базовой модели консорциума CAD и клинической модели консорциума CAD. Модели консорциума CAD рассчитывали с помощью калькулятора QxMD Pre-test Probability of CAD, который включает основные клинические проявления и традиционные сердечно-сосудистые факторы риска, такие как артериальная гипертензия, сахарный диабет, дислипидемия и курение 1. На основании этих моделей популяция исследования была разделена на три категории риска обструктивной ИБС: низкую (≤5%), среднюю (5-15%) и высокую (>15%) в соответствии с рекомендациями ЕОК [10].
Коронарная компьютерная томографическая ангиография
Всем пациентам проведена ККТА с использованием 64-срезового многодетекторного КТ-сканера (Brilliance 64, Philips Medical Systems, Best, Netherlands) в течение первых 24 ч после поступления в больницу. Для поддержания стабильной частоты сердечных сокращений всем пациентам назначали бета-блокаторы перорально или внутривенно, а при отсутствии противопоказаний применяли сублингвальный глицерилтринитрат. В качестве контрастного вещества использовали йогексол с содержанием йода 350 мг (Omnipaque 350) для улучшения визуализации коронарных артерий (КА). Изображения получали во время задержки дыхания в конце вдоха, затем данные сохраняли и анализировали в системе PACS (Carestream) с использованием программного обеспечения Vue Motion. Оценку коронарных поражений выполняли с помощью мультипланарных реконструкций (multiplanar reconstructions, MPR), применяя принцип максимальной интенсивности проекции (maximum intensity projection, MIP) и метод объёмной визуализации (volume rendering techniques, VRT). Два опытных специалиста, включая кардиолога и радиолога со стажем клинической работы >5 лет, независимо друг от друга анализировали поражения КА. Оценку исследования проводили в соответствии с рекомендациями Общества сердечно-сосудистой компьютерной томографии [15]. Каждый сегмент КА и её ветви анализировали с использованием как поперечных, так и продольных изображений, при этом степень стеноза оценивали минимум в двух ортогональных плоскостях. Фиксировалось наличие атеросклеротической бляшки и определялся её размер по отношению к диаметру непораженного атеросклерозом соседнего сегмента артерии. В обструктивную группу ИБС включали больных со степенью стеноза ≥50% по диаметру в одной из трех эпикардиальных КА диаметром ≥2,5 мм [8].
Определение переменных
Артериальная гипертензия определялась при повышении систолического артериального давления ≥140 мм рт.ст. и/или диастолического артериального давления ≥90 мм рт.ст., либо если пациент принимает антигипертензивные препараты [16]. Сахарный диабет диагностировали по уровню глюкозы натощак ≥126 мг/дл, уровню гликированного гемоглобина ≥6,5% или приёму сахароснижающих препаратов [17]. Курение значилось как продолжающееся или отказ от курения в сроке <5 лет [18]. Дислипидемия подтверждалась при общем холестерине ≥5,2 ммоль/л, триглицеридах ≥2,3 ммоль/л, холестерине липопротеидов низкой плотности ≥3,2 ммоль/л, холестерине липопротеидов высокой плотности <0,9 ммоль/л или длительном приём препаратов для лечения дислипидемии [19][20]. Семейный анамнез ранней ИБС определялся как наличие у родственника первой степени родства (мужчины <55 лет или женщины <65 лет) инфаркта миокарда или коронарной реваскуляризации [21].
Статистический анализ
Анализ данных проводили с использованием пакета программ SPSS версии 25.0. Категориальные переменные представлены в виде абсолютных и относительных частот, непрерывные переменные — в виде среднего значения (M) ± стандартного отклонения (SD) для нормально распределённых данных или медианы (Me) и межквартильного размаха (IQR) для ненормально распределённых данных. Нормальность распределения оценивали с помощью теста Колмогорова-Смирнова. Для сравнения категориальных переменных использовали критерий χ2 или точный критерий Фишера. Для сравнения непрерывных переменных с нормальным распределением применяли t-критерий Стьюдента, а для ненормально распределённых данных — критерий Манна—Уитни или тест Краскела—Уоллиса. Логистический регрессионный анализ проводили для выявления факторов в моделях ПТВ, предсказывающих обструктивную форму ИБС. Дискриминацию моделей оценивали с использованием площади под кривой (AUC) характеристической операционной (ROC), которая определяет способность модели различать обструктивную и необструктивную ИБС. Калибровку, оценивающую соответствие предсказанных и наблюдаемых результатов, проверяли с помощью критерия согласия Хосмера—Лемешоу. Различия между AUC сравнивали с использованием метода ДеЛонга [22]. Положительную прогностическую ценность каждой модели определяли как долю пациентов с обструктивной ИБС среди тех, кто классифицировался как имеющий высокий предтестовый риск, а уровень ложноотрицательных результатов — как долю пациентов с обструктивной формой ИБС среди тех, кто классифицировался как имеющий низкий предтестовый риск. Значение p<0,05 считали статистически значимым.
Результаты
В исследование включены 366 пациентов, средний возраст составил 64,8±9,1 года, 62,6% мужчин (табл. 1). Обструктивная ИБС выявлена у 270 (73,8%) пациентов. Артериальная гипертензия была наиболее распространённым сердечно-сосудистым фактором риска и выявлена у 83,1% пациентов, за ней следовали дислипидемия (55,5%), сахарный диабет (38%), курение (36,1%) и семейный анамнез ранней ИБС (9,3%).
В сравнении с группой необструктивной ИБС группа обструктивной ИБС имела значительно более высокую долю мужчин (70% vs 41,6%; p<0,001), чаще выявляли артериальную гипертензию (85,6% vs 76%; p=0,039), дислипидемию (61,9% vs 37,5%; p<0,001), курение (43,3% vs 15,6%; p<0,001) и семейный анамнез преждевременной ИБС (11,9% vs 2,1%; p=0,003). Статистически значимых различий между группами по возрасту, наличию заболеваний периферических артерий и хронической обструктивной болезнью лёгких не наблюдали.
Пациенты с обструктивной ИБС одинаково часто имели типичную и атипичную стенокардию, в то время как неспецифическая боль в груди и одышка наиболее распространены в группе необструктивной ИБС. ПТВ ИБС была значительно выше в группе обструктивной ИБС во всех трех моделях (все значения p<0,001). Кроме того, у пациентов с обструктивной ИБС отмечены более высокие уровни общего холестерина, триглицеридов и более низкие уровни липопротеидов высокой плотности.
Распределение пациентов по группам значений ПТВ и наблюдаемая распространённость обструктивной ИБС для каждой группы в трех моделях представлена на рис. 1. Согласно модели 2019 ПТВ ЕОК, 9 (2,5%) пациентов отнесены к группе с очень низкой вероятностью (ПТВ ≤5%), а 96 (26,2%) пациентов попали в группу со средней вероятностью (ПТВ 5-15%). В отличие от этого базовая модель консорциума CAD классифицировала 26 (7,1%) пациентов как имеющих низкую вероятность и 90 (24,6%) пациентов как имеющих среднюю вероятность. Наконец, клиническая модель консорциума CAD отнесла 24 (6,6%) пациента к группе низкой вероятности и 65 (17,8%) пациентов к группе средней вероятности. Среди трех моделей модель 2019 ПТВ ЕОК обеспечила наилучшую оценку распространённости обструктивной ИБС в группе низкого риска, тогда как клиническая модель консорциума CAD была наиболее точной в оценке распространённости обструктивной ИБС в группе высокого риска.
Многофакторный регрессионный анализ в каждой предсказательной модели обструктивной ИБС представлен в табл. 2. Согласно этому анализу, типичная и атипичная стенокардия являлись сильными независимыми предикторами обструктивной ИБС во всех трех предсказательных моделях (все p<0,001). Мужской пол был независимым предиктором как в модели 2019 ПТВ ЕОК, так и в базовой модели консорциума CAD (p<0,001). В клинической модели консорциума CAD курение и дислипидемия были независимыми предикторами обструкции КА с p-значениями 0,004 и 0,007, соответственно.
Анализ ROC-кривой продемонстрировал, что клиническая модель консорциума CAD имела наибольшую площадь под кривой для прогнозирования обструктивного CAD (AUC 0,760, 95% доверительный интервал (ДИ) 0,704-0,816; p<0,001), за ней следовала базовая модель консорциума CAD (AUC 0,755, 95% ДИ 0,698-0,811; p<0,001) и модель 2019 ПТВ ЕОК (AUC 0,701, 95% ДИ 0,640-0,761; p<0,001).
Диагностическая ценность и точность моделей для прогнозирования обструктивного CAD представлены в табл. 3. Тестирование качества подгонки модели показало, что клиническая и базовая модели консорциума CAD имели лучшую подгонку, с p-значениями в тесте Хосмера—Лемешоу 0,823 и 0,057, соответственно. Модель 2019 ПТВ ЕОК продемонстрировала наихудшую подгонку с p-значением 0,001.
Клиническая модель консорциума CAD продемонстрировала наивысшую прогностическую способность в отношении обструктивного CAD, с наибольшей положительной прогностической ценностью (ППЦ) 90%, чувствительностью 66,7%, специфичностью 79,2% и пороговым значением >33%. Базовая модель консорциума CAD имела ППЦ 88,2%, чувствительность — 69,3%, специфичность — 74% и пороговое значение — >22%.
Таблица 1. Клинические и демографические характеристики исследуемой популяции
|
Переменные |
Все пациенты (n=366) |
Необструктивная ИБС (n=96) |
Обструктивная ИБС (n=270) |
P |
|
Возраст, M±SD, лет |
64,8±9,1 |
64,9±11,9 |
64,7±7,9 |
0,898 |
|
Мужской пол, n (٪) |
229 (62,6) |
40 (41,7) |
189 (70) |
<0,001 |
|
ИМТ, M±SD, кг/м2 |
24,0±3,0 |
24,4±2,7 |
23,8±3,0 |
0,100 |
|
Курение, n (٪) |
132 (36,1) |
15 (15,6) |
117 (43,3) |
<0,001 |
|
Артериальная гипертензия, n (٪) |
304 (83,1) |
73 (76) |
231 (85,6) |
0,039 |
|
Сахарный диабет, n (٪) |
139 (38) |
28 (29,2) |
111 (41,1) |
0,05 |
|
Дислипидемия, n (٪) |
203 (55,5) |
36 (37,5) |
167 (61,9) |
<0,001 |
|
Семейный анамнез преждевременных ИБС, n (%) |
34 (9,3) |
2 (2,1) |
32 (11,9) |
0,003 |
|
Фибрилляция предсердий, n (٪) |
17 (4,6) |
6 (6,3) |
11 (4,1) |
0,401 |
|
Заболевание периферических артерий, n (٪) |
21 (5,7) |
3 (3,1) |
18 (6,7) |
0,306 |
|
ХОБЛ, n (٪) |
5 (1,4) |
1 (1,0) |
4 (4,1) |
1,0 |
|
Типичная стенокардия, n (٪) |
129 (35,2) |
13 (13,5) |
116 (43) |
<0,001 |
|
Атипичная стенокардия, n (٪) |
133 (36,3) |
23 (24) |
110 (40,7) |
0,003 |
|
Неангинозная боль, n (٪) |
34 (9,3) |
23 (24,0) |
11 (4,1) |
<0,001 |
|
Одышка, n (٪) |
148 (40,4) |
48 (50) |
100 (37) |
0,03 |
|
Общий холестерин, Me (IQR), ммоль/л |
4,24 (3,64; 5,45) |
4,08 (3,60; 4,71) |
4,34 (3,65; 5,71) |
0,025 |
|
ЛВП, Me (IQR), ммоль/л |
1,25 (1,06; 1,48) |
1,39 (1,17; 1,65) |
1,19 (1,03; 1,42) |
<0,001 |
|
ЛНП, Me (IQR), ммоль/л |
2,40 (1,80; 3,30) |
2,40 (1,82; 2,90) |
2,45 (1,80; 3,50) |
0,555 |
|
Триглицериды, Me (IQR), ммоль/л |
1,86 (1,33; 2,62) |
1,79 (1,14; 2,33) |
1,94 (1,35; 2,81) |
0,031 |
|
Оценка ПТВ: |
||||
|
2019 ПТВ ЕОК, Me (IQR), ٪ |
26 (14; 32) |
14 (11; 27) |
26 (16; 34) |
<0,001 |
|
Базовая модель консорциума CAD, Me (IQR), % |
27 (12,7; 45) |
13 (7; 23) |
32 (18; 50) |
<0,001 |
|
Клиническая модель консорциума CAD, Me (IQR), % |
36 (16,7; 57) |
17 (8; 31,7) |
41 (24,7; 64) |
<0,001 |
|
CAD — coronary artery disease, M — среднее значение, Me — медиана, IQR — межквартильный размах, SD — стандартное отклонение, ЕКО — Европейское общество кардиологов, ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, ЛВП — липопротеиды высокой плотности, ЛНП — липопротеиды низкой плотности, ПТВ — предтестовая вероятность, ХОБЛ — хроническая обструктивная болезнь лёгких |
||||
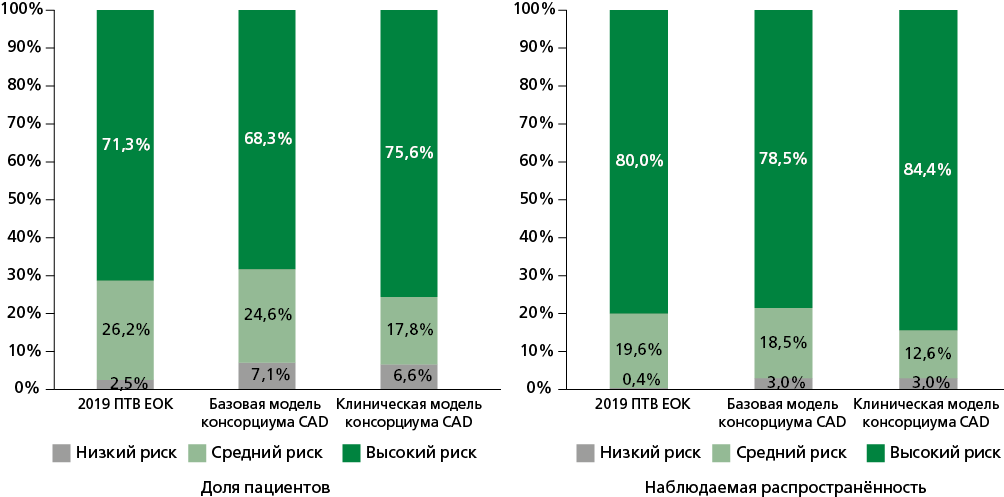
Рисунок 1. Распределение пациентов по группам ПТВ и наблюдаемая распространённость обструктивной ИБС в каждой группе, согласно оценкам трех моделей: 2019 ПТВ ЕОК, базовой модели консорциума CAD и клинической модели консорциума CAD.
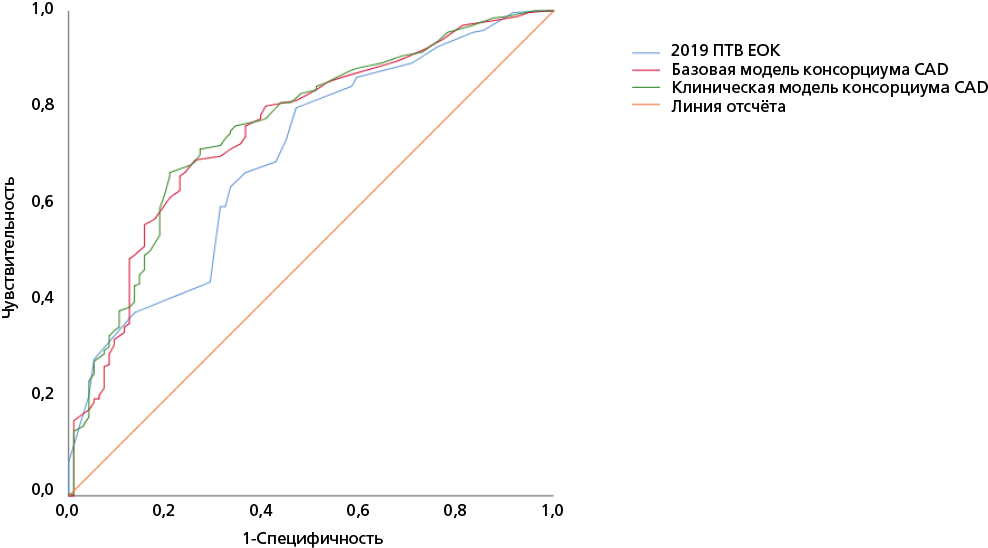
Рисунок 2. Сравнение ROC-кривых, демонстрирующих дискриминационную способность модели 2019 ПТВ ЕОК (синяя линия), базовой модели консорциума CAD (красная линия) и клинической модели консорциума CAD (зелёная линия) в прогнозировании обструктивной ИБС.
Таблица 2. Многомерный регрессионный анализ факторов в прогностических моделях обструктивной ИБС
|
Факторы |
2019 ПТВ ЕОК |
Базовая модель консорциума CAD |
Клиническая модель консорциума CAD |
|||
|
ОШ (95٪ ДИ) |
P |
ОШ (95٪ ДИ) |
P |
ОШ (95٪ ДИ) |
P |
|
|
Возраст (на 10 лет) |
0,972 (0,739-1,280) |
0,842 |
0,969 (0,736-1,274) |
0,821 |
0,923 (0,687-1,242) |
0,788 |
|
Мужской пол |
2,931 (1,692-5,075) |
<0,001 |
2,881 (1,669-4,973) |
<0,001 |
1,517 (0,795-2,894) |
0,206 |
|
Типичная стенокардия |
11,144 (4,487-27,677) |
<0,001 |
9,437 (4,430-20,105) |
0,001 |
9,882 (4,492-21,739) |
<0,001 |
|
Атипичная стенокардия |
6,288 (2,566-15,409) |
<0,001 |
5,152 (2,643-10,042) |
0,004 |
4,664 (2,324-9,357) |
<0,001 |
|
Неангинозная боль |
0,729 (0,238-2,232) |
0,580 |
0,581 (0,237-1,423) |
0,235 |
0,683 (0,267-1,751) |
0,428 |
|
Одышка |
1,298 (0,602-2,797) |
0,505 |
- |
- |
- |
- |
|
Артериальная гипертензия |
- |
- |
- |
- |
2,082 (0,977-4,440) |
0,058 |
|
Сахарный диабет |
- |
- |
- |
- |
1,487 (0,812-2,724) |
0,199 |
|
Курение |
- |
- |
- |
- |
3,146 (1,440-6,872) |
0,004 |
|
Дислипидемия |
- |
- |
- |
- |
2,183 (1,243-3,835) |
0,007 |
|
CAD — coronary artery disease, ДИ — доверительный интервал, ЕОК — Европейское общество кардиологов, ИБС — ишемическая болезнь сердца, ОШ — отношение шансов, ПТВ — предтестовая вероятность |
||||||
Таблица 3. Сравнение качества подгонки моделей и диагностической точности между моделью 2019 ПТВ ЕОК и базовой и клинической моделями консорциума CAD для прогнозирования обструктивной ИБС
|
Параметры |
2019 ПТВ ЕОК |
Базовая модель консорциума CAD |
Клиническая модель консорциума CAD |
|
Чувствительность, ٪ |
80 |
69,3 |
66,7 |
|
Специфичность, ٪ |
53,1 |
74 |
79,2 |
|
ППЦ, ٪ |
82,8 |
88,2 |
90 |
|
ОПЦ, ٪ |
48,6 |
46,1 |
45,8 |
|
Пороговое значение, ٪ |
>14 |
>22 |
>33 |
|
Тест Хосмера—Лемешоу |
χ2 =27,468; p=0,001 |
χ2 =15,097; p=0,057 |
χ2 =4,364; p=0,823 |
|
CAD — coronary artery disease, ИБС — ишемическая болезнь сердца, ЕОК — Европейское общество кардиологов, ППЦ — положительная прогностическая ценность, ОПЦ — отрицательная прогностическая ценность, ПТВ — предтестовая вероятность |
|||
Обсуждение
Клиническая модель консорциума CAD превосходит как базовую модель консорциума CAD, так и модель 2019 ПТВ ЕОК в прогнозировании обструктивной ИБС у пациентов со стабильной стенокардией. При пороге >33% она продемонстрировала наивысшую ППЦ (90%) и чувствительность (66,7%). Клиническая модель CAD также показала лучшую диагностическую точность с AUC 0,760 по сравнению с базовой моделью CAD (AUC 0,755) и моделью 2019 ПТВ ЕОК (AUC 0,701). Эти результаты подчёркивают важность включения дополнительных факторов сердечно-сосудистого риска для улучшения оценки ПТВ.
Распространённость обструктивной ИБС, диагностированной с помощью ККТА в исследовании, составила 71,3%, что значительно выше, чем предсказано моделью 2019 ПТВ ЕОК во всех трех категориях риска. Напротив, в исследовании PROMISE [23], проведённом в Северной Америке среди 4415 симптоматических амбулаторных пациентов без ранее выявленной ИБС, сообщалось о гораздо более низкой распространённости обструктивной ИБС (≥50% стеноза) — всего 13,9%. Интересно, что 97% пациентов в исследовании PROMISE классифицированы как имеющие средний риск по модели 2019 ПТВ ЕОК, причём только 3,6% отнесены в группу низкого риска и 0,6% — в группу высокого риска. Аналогично в субанализе исследования SCOT-HEART (Scottish COmputed Tomography of the HEART) [24], включавшем 3755 пациентов со стабильной стенокардией, общая распространённость обструктивной ИБС составила 22% среди 1613 пациентов, которым была проведена ККТА. Распространённость ИБС в группах низкого, среднего и высокого риска составила 13,2%, 29,2% и 57,6%, соответственно, что было значительно ниже, чем в нашей когорте. Эти результаты свидетельствуют, что модель 2019 ПТВ ЕОК хорошо калибрована для выявления ИБС у пациентов с низким риском, как показано в исследованиях PROMISE и SCOT-HEART. Однако существует недостаток валидации этой модели в популяции высокого риска. Внешняя валидация в таких популяциях может привести к разработке обновленных моделей ПТВ ЕОК, адаптированных для стран с высоким риском, что способствует более точной диагностике ИБС и улучшению результатов лечения в регионах с высокой заболеваемостью. Как указано в рекомендациях ЕОК 2019 г., расчёт ПТВ влияет на стратегии тестирования для диагностики ИБС, подчеркивая необходимость усовершенствования модели для разных популяций.
Средний возраст участников исследования составил 64,8±9,1 года, что немного выше, чем в исследовании U. W. Lee и соавт. [25] в Корее (62±12,7 года) и в анализе L. Baskaran и соавт. [12] в Сингапуре (58±10 лет) в рамках SCOT-HEART. В отличие от этих исследований не выявлено значимых различий в возрасте между пациентами с обструктивной и необструктивной ИБС. Доля мужчин (62,6%) была сопоставима с таковой в публикации U. W. Lee и соавт. [25] (60,8%), но выше, чем в исследованиях L. Baskaran и соавт. [12] (56,9%) и J. Zheng и соавт. [26] (50,9%) в крупной китайской когорте из 11 234 пациентов с подозрением на ИБС. Это может отражать региональные или популяционные различия в распространённости ИБС среди мужчин и женщин или в распределении факторов риска.
Проведённое исследование также выявило более высокие показатели сердечно-сосудистого риска по сравнению с другими исследованиями. Артериальная гипертензия, сахарный диабет, дислипидемия и курение присутствовали у 83,1%, 38%, 55,5% и 36,1% пациентов, соответственно, что значительно выше, чем в исследовании L. Baskaran и соавт. [12] (40,6%, 14,8%, 58,4% и 23,6%) и U. W. Lee и соавт. [25] (43,1%, 20%, 15,9% и 8,9%). Эти данные могут объяснить превосходство клинической модели консорциума ИБС, которая учитывает традиционные факторы риска (дислипидемия и курение). Высокая распространённость этих факторов риска в нашей популяции подчеркивает необходимость моделей, которые принимают их во внимание при прогнозировании ИБС.
У пациентов с обструктивной ИБС в исследовании чаще наблюдали типичную или атипичную стенокардию, в то время как у пациентов с необструктивной ИБС чаще отмечали неангинозные боли в груди, что частично соответствует предыдущим исследованиям [12][25][27][28]. Однако результаты исследования отличаются от работы U. W. Lee и соавт. [25], где атипичная стенокардия чаще встречалась у пациентов с необструктивной ИБС (50,4% vs 36,6%, p<0,001). Аналогично L. Baskaran и соавт. [12] сообщили о более высокой частоте атипичной стенокардии при необструктивной ИБС (26,2% vs 20,8%, p=0,01). Эти различия могут быть связаны с вариациями в популяциях пациентов или клинических условиях.
Руководство АКК/АКА 2021 г. [14] по оценке и диагностике болей в груди исключило категоризацию симптомов из оценки ПТВ, чтобы устранить возможную путаницу, связанную с термином "атипичная стенокардия". Согласно новым рекомендациям, спектр симптомов, приравниваемых к стенокардии, расширен и включает ощущение сдавления в груди, дискомфорт в области шеи, нижней челюсти и верхней части живота, а также симптомы, такие как одышка и утомляемость. Несмотря на эти изменения, включение характерности симптомов в модель ПТВ, согласно ЕОК, продемонстрировало более высокую точность в прогнозировании ИБС по сравнению с моделью АКК/АКА [10]. В исследовании S. Winther и соавт. [29], включавшем 50 561 пациента с подозрением на стенокардию, направленных на ККТА, распределение симптомов было следующим: у 12% наблюдалась типичная стенокардия, у 48% — атипичная, у 31% — неангинозные боли в груди, а 8% не испытывали боль в груди, но жаловались на одышку. При сравнении диагностических моделей модель ПТВ по АКК/ААЦ имела AUC 0,715 (95% ДИ 0,707-0,722), в то время как включение характерных симптомов в модель ПТВ ЕОК значительно улучшало диагностику ИБС — AUC составила 0,755 (95% ДИ 0,747-0,763). Более того, включение как типа симптомов, так и факторов риска в модель клинической вероятности, взвешенную по факторам риска, ещё больше повышало точность диагностики — AUC достигала 0,777 (95% ДИ 0,770-0,785). Эти результаты подчёркивают важность учёта как клинических проявлений, так и факторов риска при диагностике ИБС.
Разработка высококачественной модели клинического прогноза должна обеспечивать простую и точную оценку индивидуальной вероятности заболевания, способствуя принятию клинических решений. Эффективная модель должна хорошо различать пациентов с заболеванием и без него, а также обеспечивать хорошую калибровку, то есть соответствие между предсказанной и фактической распространённостью заболевания. Кроме того, такая модель должна улучшать стратификацию пациентов и уменьшать количество случаев с неопределённой тактикой ведения. После валидации модели должны быть определены соответствующие пороговые значения для принятия решений. В исследовании S. Winther и соавт. [29] модель 2019 ПТВ ЕОК незначительно переоценивала распространённость ИБС, в то время как модель консорциума CAD демонстрировала лучшую калибровку с коэффициентами 1,12 и 1,05, соответственно. При сравнении способности моделей различать обструктивную и необструктивную ИБС, модель 2019 ПТВ ЕОК показала более низкий AUC — 0,755 (95% ДИ 0,747-0,763; p<0,001) по сравнению с моделью консорциума CAD — AUC 0,777 (95% ДИ 0,770-0,785; p<0,001).
В исследовании клиническая модель консорциума CAD продемонстрировала наилучшую дискриминацию, с AUC 0,760, что согласуется с предыдущими данными [30]. Это может быть связано с включением дополнительных сердечно-сосудистых факторов риска, повышающих применимость модели в разных популяциях [31]. Схожие результаты получены M. S. Bittencourt и соавт. [13] в исследовании 2274 пациентов (средний возраст — 56±13 лет, 57% мужчин), прошедших ККТА в клиниках Массачусетского госпиталя общего профиля и госпиталя Бригама и женской больницы (США). AUC базовой и клинической моделей консорциума CAD составили 0,7517 и 0,7909, соответственно (все p<0,001). Однако в популяциях с более высокой распространённостью ИБС дискриминирующая способность модели снижалась. Так, J. Almeida и соавт. [32] обследовали 2234 пациента (средний возраст — 63,7 года) (67,5% мужчин), из которых 66,9% имели типичную стенокардию, обструктивная ИБС выявлена у 58,5%. Базовая и клиническая модели консорциума CAD показали AUC 0,664 (95% ДИ 0,641-0,687; p<0,001) и 0,683 (95% ДИ 0,661-0,706; p<0,001), соответственно. В исследовании L. Baskaran и соавт. [12] клиническая модель консорциума CAD имела более низкое значение AUC — 0,718 (95% ДИ 0,668-0,767), однако повторная калибровка с обновлёнными коэффициентами регрессии улучшила AUC до 0,767 (95% ДИ 0,721-0,814). Тест Хосмера—Лемешоу показал слабую подгонку модели: переоценка частоты обструктивной ИБС составила 13% у женщин и 28% у мужчин. Подобную картину наблюдали в исследовании U. W. Lee и соавт. [25], где AUC базовой и клинической моделей консорциума CAD составили 0,736 (95% ДИ 0,692-0,780) и 0,754 (95% ДИ 0,711-0,797), соответственно. Однако обе модели неправильно классифицировали 17 и 25% пациентов с обструктивной ИБС, соответственно.
В представленном исследовании базовая модель консорциума CAD продемонстрировала приемлемую прогностическую точность для обструктивной ИБС — AUC 0,755, что несколько ниже, чем в оригинальном исследовании T. S. Genders и соавт. (AUC 0,77) [30], но выше, чем в проспективном исследовании J. M. Jensen и соавт. [33] на 633 пациентах с подозрением на стенокардию, где обструктивная ИБС определялась как стеноз ≥50%, а клиническая модель консорциума CAD показала AUC 0,714. Эти результаты подтверждают, что, несмотря на высокую дискриминацию, эффективность клинической модели консорциума CAD может варьировать в зависимости от популяции, особенно при разной распространённости ИБС и профиле факторов риска.
Ограничения исследования
Проведённое исследование имеет ряд ограничений. Во-первых, оно проводилось в одном центре, что может ограничить обобщаемость результатов на другие популяции с отличающимися системами здравоохранения или демографическими характеристиками. Во-вторых, одномоментный дизайн не позволяет оценить долгосрочные исходы, такие как прогрессирование ИБС или влияние решений, принятых на основе прогностических моделей. В-третьих, в исследование в основном были включены пациенты со стабильной стенокардией, проходящие ККТА, что не полностью отражает пациентов с другими формами ИБС или с низким сердечно-сосудистым риском. Кроме того, хотя модели ПТВ консорциума CAD и ЕОК 2019 г. валидированы в разных когортных исследованиях, их эффективность может варьировать в зависимости от этнических или региональных особенностей. В связи с этим необходима дополнительная валидация на более крупных и разнообразных выборках. Для подтверждения результатов и оценки широкого применения этих прогностических моделей в разных клинических условиях необходимы дальнейшие проспективные многоцентровые исследования.
Заключение
Клиническая модель консорциума CAD обеспечила наилучшую дискриминацию и наивысшую диагностическую точность при прогнозировании обструктивной ИБС по сравнению с моделью 2019 ПТВ ЕОК. Включение дополнительных факторов сердечно-сосудистого риска повышает её эффективность и делает более подходящей для популяции высокого риска. Рекомендуется применение клинической модели консорциума CAD в рутинной клинической практике для более точных расчетов ПТВ у пациентов со стабильной стенокардией, что снизит количество ненужных тестов и улучшит клинические результаты лечения пациентов. Дальнейшая валидация модели 2019 ПТВ ЕОК в разных популяциях высокого риска необходима для оптимизации её клинического применения.
1. https://qxmd.com/calculate/calculator_287/pre-test-probability-of-cad-cad-consortium
Список литературы
1. Gandhi S, Garratt KN, Li S, et al. Ten-Year Trends in Patient Characteristics, Treatments, and Outcomes in Myocardial Infarction from National Cardiovascular Data Registry Chest Pain-MI Registry. Circ Cardiovasc Qual Outcomes. 2022;15(1):E008112. DOI:10.1161/CIRCOUTCOMES.121.008112.
2. Safiri S, Karamzad N, Singh K, et al. Burden of ischemic heart disease and its attributable risk factors in 204 countries and territories, 1990-2019. Eur J Prev Cardiol. 2022;29(2):420-31. DOI:10.3389/fcvm.2022.868370.
3. Hoorweg BB, Willemsen RT, Cleef LE, et al. Frequency of chest pain in primary care, diagnostic tests performed and final diagnoses. Heart. 2017;103(21):1727- 32. DOI:10.1136/heartjnl-2016-310905.
4. Knuuti J, Ballo H, Juarez-Orozco LE, et al. The performance of non-invasive tests to rule-in and rule-out significant coronary artery stenosis in patients with stable angina: A meta-analysis focused on post-test disease probability. Eur Heart J. 2018;39(35):3322-30. DOI:10.1093/eurheartj/ehy267.
5. Hecht HS, Shaw L, Chandrashekhar YS, et al. Should NICE guidelines be universally accepted for the evaluation of stable coronary disease? A debate. Eur Heart J. 2019;40(18):1440-53. DOI:10.1093/eurheartj/ehz024.
6. Fihn SD, Gardin JM, Abrams J, et al; American College of Cardiology Foundation. 2012 ACCF/AHA/ACP/AATS/PCNA/SCAI/STS guideline for the diagnosis and management of patients with stable ischemic heart disease: executive summary: a report of the American College of Cardiology Foundation/American Heart Association task force on practice guidelines, and the American College of Physicians, American Association for Thoracic Surgery, Preventive Cardiovascular Nurses Association, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. Circulation. 2012;126(25):3097-137. DOI:10.1161/CIR.0b013e3182776f83.
7. Task Force Members; Montalescot G, Sechtem U, Achenbach S, et al. 2013 ESC guidelines on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J. 2013;34(38):2949-3003. DOI:10.1093/eurheartj/eht296.
8. Rademaker AA, Danad I, Groothuis JG, et al. Comparison of different cardiac risk scores for coronary artery disease in symptomatic women: Do female-specific risk factors matter? Eur J Prev Cardiol. 2014;21(11):1443-50. DOI:10.1177/2047487313494571.
9. Pickett CA, Hulten EA, Goyal M, et al. Accuracy of traditional age, gender and symptom based pre-test estimation of angiographically significant coronary artery disease in patients referred for coronary computed tomographic angiography. Am J Cardiol. 2013;112(2):208-11. DOI:10.1016/j.amjcard.2013.03.015.
10. Knuuti J, Wijns W, Saraste A, et al; ESC Scientific Document Group. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41(3):407-77. DOI:10.1093/eurheartj/ehz425.
11. Juarez-Orozco LE, Saraste A, Capodanno D, et al. Impact of a decreasing pre-test probability on the performance of diagnostic tests for coronary artery disease. Eur Heart J Cardiovasc Imaging. 2019;20(11):1198-207. DOI:10.1093/ehjci/jez054.
12. Baskaran L, Danad I, Gransar H, et al. A Comparison of the Updated DiamondForrester, CAD Consortium, and CONFIRM History-Based Risk Scores for Predicting Obstructive Coronary Artery Disease in Patients With Stable Chest Pain: The SCOT-HEART Coronary CTA Cohort. JACC Cardiovasc Imaging. 2019;12(7):1392-400. DOI:10.1016/j.jcmg.2018.02.020.
13. Bittencourt MS, Hulten E, Polonsky TS, et al. European Society of CardiologyRecommended Coronary Artery Disease Consortium Pretest Probability Scores More Accurately Predict Obstructive Coronary Disease and Cardiovascular Events Than the Diamond and Forrester Score: The Partners Registry. Circulation. 2016;134(3):201-11. DOI:10.1161/CIRCULATIONAHA.116.023396.
14. Writing Committee Members; Gulati M, Levy PD, Mukherjee D, et al. 2021 AHA/ ACC/ASE/CHEST/SAEM/SCCT/SCMR Guideline for the Evaluation and Diagnosis of Chest Pain: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2021;78(22):e187-e285. DOI:10.1016/j.jacc.2021.07.053.
15. Lawton JS, Tamis-Holland JE, Bangalore S, et al. 2021 ACC/AHA/SCAI Guideline for Coronary Artery Revascularization: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2022;145(3):e4-e17. DOI:10.1161/CIR.0000000000001039.
16. Williams B, Mancia G, Spiering W, et al; ESC Scientific Document Group. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2018;39(33):3021-104. DOI:10.1093/eurheartj/ehy339.
17. American Diabetes Association. Standards of Medical Care in Diabetes — 2022 Abridged for Primary Care Providers. Clin Diabetes. 2022;50(1):10-38. DOI:10.2337/cd17-0119.
18. Parascandola M, Augustson E, Rose A. Characteristics of current and recent former smokers associated with the use of new potential reduced-exposure tobacco products. Nicotine Tob Res. 2009;11(12):1431-38. DOI:10.1093/ntr/ntp157.
19. National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation. 2002;106(25):3143-421.
20. Kavey RE, Daniels SR, Lauer RM, et al. American Heart Association guidelines for primary prevention of atherosclerotic cardiovascular disease beginning in childhood. Circulation. 2003;107(11):1562-6. DOI:10.1161/01.cir.0000061521.15730.6e.
21. Michos ED, Choi AD. Coronary Artery Disease in Young Adults: A Hard Lesson But a Good Teacher. J Am Coll Cardiol. 2019;74(15):1879-82. DOI:10.1016/j.jacc.2019.08.1023.
22. DeLong ER, DeLong DM, Clarke-Pearson DL. Comparing the areas under two or more correlated receiver operating characteristic curves: a nonparametric approach. Biometrics. 1988;44(3):837-45.
23. Foldyna B, Udelson JE, Karády J, et al. Pretest probability for patients with suspected obstructive coronary artery disease: Re-evaluating DiamondForrester for the contemporary era and clinical implications: Insights from the PROMISE trial. Eur Heart J Cardiovasc Imaging. 2019;20(5):574-81. DOI:10.1093/ehjci/jey182.
24. Bing R, Singh T, Dweck MR, et al. Validation of European Society of Cardiology pre-test probabilities for obstructive coronary artery disease in suspected stable angina. Eur Hear J Qual Care Clin Outcomes. 2020;6(4):293-300. DOI:10.1093/ehjqcco/qcaa006.
25. Lee UW, Ahn S, Shin YS, et al. Comparison of the CAD consortium and updated Diamond-Forrester scores for predicting obstructive coronary artery disease. Am J Emerg Med. 2021;43:200-4. DOI:10.1016/j.ajem.2020.02.056.
26. Zheng J, Hou Z, Yin W, et al. Performance of the 2019 ESC pre-test probability model in predicting obstructive coronary artery disease in a Chinese population using coronary computed tomography angiography outcomes. J Cardiovasc Comput Tomogr. 2024;18(4):408-15. DOI:10.1016/j.jcct.2024.04.011.
27. Chen T, Shao D, Zhao J, et al. Comparison of the RF-CL and CACS-CL models to estimate the pretest probability of obstructive coronary artery disease and predict prognosis in patients with stable chest pain and diabetes mellitus. Front Cardiovasc Med. 2024;11:1368743. DOI:10.3389/fcvm.2024.1368743.
28. Vranic I, Stankovic I, Ignjatovic A, et al. Validation of the European Society of Cardiology pretest probability models for obstructive coronary artery disease in high-risk population. Hellenic J Cardiol. 2024:S1109-9666(24)00107-6. DOI:10.1016/j.hjc.2024.05.003.
29. Winther S, Murphy T, Schmidt SE, et al. Performance of the American Heart Association/American College of Cardiology Guideline-Recommended Pretest Probability Model for the Diagnosis of Obstructive Coronary Artery Disease. J Am Heart Assoc. 2022;11(24):e027260. DOI:10.1161/JAHA.122.027260.
30. Genders TS, Steyerberg EW, Alkadhi H, et al. A clinical prediction rule for the diagnosis of coronary artery disease: Validation, updating, and extension. Eur Heart J. 2011;32(11):1316-30. DOI:10.1093/eurheartj/ehr014.
31. Genders TS, Steyerberg EW, Hunink MG, et al. Prediction model to estimate presence of coronary artery disease: Retrospective pooled analysis of existing cohorts. BMJ. 2012;344:e3485. DOI:10.1136/bmj.e3485.
32. Almeida J, Fonseca P, Dias T, et al. Comparison of Coronary Artery Disease Consortium 1 and 2 Scores and Duke Clinical Score to Predict Obstructive Coronary Disease by Invasive Coronary Angiography. Clin Cardiol. 2016;39(4): 223-8. DOI:10.1002/clc.22515.
33. Jensen JM, Voss M, Hansen VB, et al. Risk stratification of patients suspected of coronary artery disease: Comparison of five different models. Atherosclerosis. 2012;220(2):557-62. DOI:10.1016/j.atherosclerosis.2011.11.027.
Об авторах
Ч. Х. ХоангВьетнам
Хоанг Чыонг Хюй, канд. мед. наук, преподаватель кафедры внутренних болезней, Медицинский университет Фам Нгок Тач; врач-кардиолог, кардиологическое отделение 5, Кардиологическая больница Там Дык
Хошимин
Д. В.Б. До
Вьетнам
До Дан Ван Буу, генеральный директор, заведующий отделением кардиологической электрофизиологии
Хошимин
Т. Л.Ф. Нгуен
Вьетнам
Нгуен Тао Ле Фыонг, кардиолог консультативно-диагностического отделения
Хошимин
В. В. Майсков
Россия
Майсков Виктор Викторович, к.м.н, доцент кафедры внутренних болезней с курсом кардиологии и функциональной диагностики имени В.С. Моисеева Медицинского института РУДН; зав. отделением рентгенохирургических методов диагностики и лечения, Университетская клиническая больница имени В. В. Виноградова (филиал)
Москва
Ж. Д. Кобалава
Россия
Кобалава Жанна Давидовна, чл.-кор. РАН, д-р мед. наук, проф., зав. каф. внутренних болезней с курсом кардиологии и функциональной диагностики им. В.С. Моисеева Медицинского института
Москва
Рецензия
Для цитирования:
Хоанг Ч.Х., До Д.В., Нгуен Т.Л., Майсков В.В., Кобалава Ж.Д. Диагностическая ценность моделей предтестовой вероятности Европейского общества кардиологов 2019 г. и консорциума Coronary Artery Disease в оценке обструктивной ишемической болезни сердца. Рациональная Фармакотерапия в Кардиологии. 2025;21(2):98-107. https://doi.org/10.20996/1819-6446-2025-3127. EDN: FLGXNG
For citation:
Hoang H.T., Do D.V., Nguyen T.L., Maiskov V.V., Kobalava Z.D. Diagnostic performance of the 2019 ESC pre-test probability and Coronary Artery Disease consortium models in estimating obstructive coronary artery disease. Rational Pharmacotherapy in Cardiology. 2025;21(2):98-107. https://doi.org/10.20996/1819-6446-2025-3127. EDN: FLGXNG

















































