Перейти к:
Восполнение внутриклеточного дефицита магния при нарушениях сердечного ритма: в фокусе физико-химические свойства комплексных соединений
https://doi.org/10.20996/1819-6446-2025-3149
EDN: NZEGLS
Аннотация
Цель. На основе оценки физико-химических свойств комплексных соединений магния и экспериментов с изолированными предсердными кардиомиоцитами крысы выявить наиболее перспективный состав лекарственного препарата, влияющий на восполнение внутриклеточного дефицита магния.
Материалы и методы. Проводились оценка осмоляльности растворов, содержащих комплексные соединения магния, их экстракция в органические растворители разной полярности (хлороформ и бутанол), а также определение диффузии через модель клеточной мембраны (бумажный фильтр, модифицированный лецитином). В экспериментах на изолированных предсердных кардиомиоцитах крысы проведено тестирование составов на восполнение внутриклеточного (цитозольного) дефицита магния с применением методов лазерной сканирующей (конфокальной) микроскопии.
Результаты. Исходя из экспериментальных данных, полученных в ходе физико-химического тестирования препаратов магния и опытов, проведённых на кардиомиоцитах лабораторных животных, наиболее перспективным в отношении восполнения внутриклеточного магния оказалась система на основе аспарагината магния, в которой соотношение ионов магния к аспарагиновой кислоте составляет 1 к 2,5. 30-мин инкубация кардиомиоцитов с данным препаратом приводила к повышению цитозольного [Mg2+]i на 115% относительно значений контрольного уровня. Удаление избытка ионов калия из системы аспарагината калия и магния смещает рН в сторону более физиологичного значения (от 6,8 до 7,3), при этом липофильные свойства (экстракция в органические растворители и диффузия через лецитиновый фильтр) усиливаются в два раза.
Заключение. В работе представлен методологический подход к анализу комплексных соединений магния для восполнения внутриклеточного дефицита, включающий тип комплексного соединения, его концентрацию, липофильность, а также осмоляльность исходной системы. Данные, полученные в ходе экспериментов, были подтверждены в трансляционном опыте с изолированными предсердными кардиомиоцитами, позволяющем выделить наиболее перспективный комплекс в отношении восполнения внутриклеточного дефицита магния.
Ключевые слова
Для цитирования:
Божко Я.Г., Белоконова Н.А., Медведева О.М., Бутова К.А., Архипов М.В. Восполнение внутриклеточного дефицита магния при нарушениях сердечного ритма: в фокусе физико-химические свойства комплексных соединений. Рациональная Фармакотерапия в Кардиологии. 2025;21(2):155-165. https://doi.org/10.20996/1819-6446-2025-3149. EDN: NZEGLS
For citation:
Bozhko Ya.G., Belokonova N.A., Medvedeva O.M., Butova K.A., Arkhipov M.V. Replenishment of intracellular magnesium deficiency in cardiac arrhythmias: focus on the physicochemical properties of complex compounds. Rational Pharmacotherapy in Cardiology. 2025;21(2):155-165. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3149. EDN: NZEGLS
Введение
Магний — важнейший внутриклеточный ион, наряду с натрием, калием и кальцием, являющийся кофактором более чем 300 ферментативных реакций [1]. Универсальность магния как участника биохимических процессов организма во многом определяется его способностью к образованию комплексов с молекулами аденозинтрифосфата, что обеспечивает высвобождение энергии через активацию магний-зависимых аденозинтрифосфераз [2]. Магний имеет ключевое значение в регуляции внутриклеточного электролитного баланса за счёт участия элемента в энергообеспечении ионных каналов мембран митохондрий и саркоплазматических ретикулумов, а также наличия антагонистических взаимоотношений с кальцием [3]. С позиций электрофизиологии магний способствует уменьшению автоматизма сердца, удлинению предсердной, желудочковой и атриовентрикулярной проводимости, угнетению ранних и задержанных постдеполяризаций. Под контролем магния находятся 2, 3 и 4 фазы потенциала действия сократительных кардиомиоцитов и 0, 3 фазы потенциала действия пейсмекерных клеток [4]. Учитывая значимый вклад магния в обеспечение стабильности клеточных мембран и электрофизиологических процессов, происходящих в сердце, гипомагниемия провоцирует развитие нарушений сердечного ритма, в частности, фибрилляции предсердий (ФП) [5][6]. Несмотря на то что в ряде случаев у пациентов с ФП содержание магния в плазме крови может быть нормальным или умеренно сниженным, при анализе данного электролита в форменных элементах (внутриклеточно) обнаруживается его существенный дефицит, коррелирующий с частотой возникновения пароксизмов аритмии [7][8]. При этом восполнение внутриклеточного дефицита магния является важной и окончательно нерешённой задачей для современной аритмологии ввиду сложного транспорта данного катиона в клетку и наличия физико-химических особенностей существующих лекарственных препаратов (ЛП), направленных в большей степени на восполнение внеклеточного дефицита магния [9]. В качестве первоначальной модели in vitro для оценки свойств ЛП магния, позволяющих спрогнозировать их биодоступность, авторами статьи предложено использовать диффузию через лецитиновый фильтр и перераспределение в неполярные растворители — хлороформ или бутанол, что в большей степени характеризует липофильность исследуемых комплексных соединений. Такой подход показал состоятельность и взаимосвязь с результатами других исследований [10], оценивающих биодоступность магния в физиологических опытах с лабораторными животными. В ходе дальнейших экспериментов установлено, что биодоступность магния повышалась при разбавлении существующего ЛП на основе аспарагината калия и магния 5% раствором глюкозы и при добавлении витамина В6 в качестве дополнительного лиганда [9]. Поскольку ряд экспериментальных наблюдений свидетельствует, что увеличению биодоступности магния способствует образование его нейтральных комплексных соединений, а также повышение скорости диффузии катиона в растворе глюкозы, авторами поставлена задача поиска способов корректировки состава существующих ЛП в целях улучшения восполнения внутриклеточного дефицита изучаемого элемента.
Цель исследования — выявить на основе оценки физико-химических свойств комплексных соединений магния и экспериментов с изолированными предсердными кардиомиоцитами крысы наиболее перспективный состав ЛП, влияющий на восполнение внутриклеточного дефицита магния.
Материалы и методы
Исследуемые растворы
Для исследования использованы фармацевтические субстанции, готовые ЛП и модельные водные системы, содержащие ионы магния с разными лигандами:
- "Магния аспарагинат", фармацевтическая субстанция (производство "Ирбитский фармацевтический завод", г. Ирбит, Россия), сухое вещество, из которого приготовлен водный раствор с массовой концентрацией вещества 0,82%.
- ЛП "Калия магния аспарагинат" (КМА), раствор для инфузий (производство АО "Фармасинтез", г. Иркутск, Россия).
- Модельные водные системы с разным мольным соотношением ионов Mg2+и лигандов (аспарагината и цитрата). Синтез проводили с использованием химических реагентов оксид магния (чистый для анализа), L-аспарагиновая кислота (химически чистый), лимонная кислота (химически чистый). Методика синтеза основана на схеме, используемой в промышленном синтезе препарата КМА 1: в стакан, снабжённый мешалкой, помещали 90 мл дистиллированной воды, нагревали до температуры 70 °С. Добавляли 0,11 г оксида магния, перемешивали в течение 20 мин. При температуре 70 °С добавляли L-аспарагиновую (Asp) или лимонную (Citr) кислоты. Далее перемешивали реакционную смесь 30 мин, охлаждали и добавляли дистиллированную воду до 100 мл. Измеряли значение рН. Для нейтрализации величины рН использовали гидроксид калия. В часть водных систем добавляли ЛП пиридоксин (витамин B6) — раствор для инъекций с содержанием пиридоксина гидрохлорида 50 мг/мл (производство ПАО "Биосинтез", г. Пенза, Россия).
Состав исследуемых растворов указан в табл. 1.
Дизайн исследования
Оценку физико-химических свойств растворов соединений магния проводили по показателям:
- осмоляльность растворов;
- экстракция в органические растворители разной полярности (хлороформ и бутанол);
- диффузия через бумажный фильтр, модифицированный лецитином (имитация клеточной мембраны).
Экстракцию соединений магния в хлороформ и бутанол проводили при условии: к 10 мл пробы добавляли 5 мл хлороформа или бутанола, перемешивали 45 мин при температуре 25 °С. Содержание ионов магния определяли в водной фазе до и после экстракции методом трилонометрии.
Коэффициент распределения считали по формуле (1):
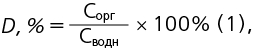
где D, % — коэффициент распределения соединений магния в органический растворитель, выраженный в процентах, Сорг — молярная концентрация соединений магния в органическом растворителе, Сводн — молярная концентрация соединений магния в водной фазе.
Перераспределение ионов магния в составе комплексов определяли по изменению концентрации ионов магния в водной фазе.
Для изучения диффузии ионов магния в составе комплексов использована установка, схема которой приведена в работе Н. А. Белоконовой и соавт. [11]. Установка состоит из камеры для образца и камеры выявления, которые разделены мембраной. В камеру для образца помещали исследуемые растворы ЛП магния, а в камере выявления находился 0,9% раствор хлорида натрия. Содержание ионов магния определяли в камере для образца до и после диффузии методом трилонометрии. Относительное понижение концентрации ионов магния рассчитывали по формуле (2):
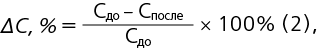
где ΔС, % — относительное понижение концентрации ионов магния, выраженное в процентах, Сдо — молярная концентрация соединений магния до диффузии через лецитиновую мембрану, Спосле — молярная концентрация соединений магния после диффузии через лецитиновую мембрану. Методика приготовления бумажного фильтра, модифицированного лецитином [11], была скорректирована: 2 г лецитина взвешивали и растворяли в 10 мл диметилового эфира. В чашку Петри помещали последовательно два бумажных фильтра ("синяя лента", диаметр 10 см) и заливали полученным раствором, далее фильтры вынимали, высушивали, взвешивали. Масса лецитина на бумажном фильтре составляла 1±0,1 г. Модифицированный лецитином фильтр закрепляли в установку для изучения диффузии.
Ионную силу растворов (I) рассчитывали по формуле (3):
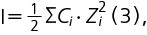
где I — ионная сила раствора, Сi — молярная концентрация каждого иона, Zi — заряд каждого иона.
Активную концентрацию ионов магния рассчитывали по формуле (4) теории Дебая—Хюккеля [13]:
a = f·С (4),
где a — активная концентрация ионов магния (моль/л), С — молярная концентрация ионов магния, f — коэффициент активности, рассчитанный по формуле второго приближения (5):
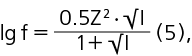
где lg f — десятичный логарифм коэффициента активности ионов магния, Z — заряд ионов магния, I — ионная сила раствора.
Осмоляльность измеряли на криометрическом медицинском осмометре ОСКР-1М.
Для верификации восполнения внутриклеточного (цитозольного) дефицита магния исследуемыми растворами был проведен трансляционный эксперимент с изолированными кардиомиоцитами предсердий крыс.
Одиночные кардиомиоциты предсердий получали из сердец здоровых самцов крыс линии Wistar возрастом 10 нед. и массой тела 250-310 г (n=2). Животные содержались в условиях вивария с 12-часовым световым днём с неограниченным доступом к воде и к стандартному корму (комбикорм для лабораторных мышей и крыс Дельта Фидс, ЛбК 120 С-19; БиоПро). При проведении исследований с использованием лабораторных животных авторы действовали в соответствии с директивой 2010/63/EU "О защите животных, используемых в научных целях".
За 30 мин до эвтаназии животным проводилась инъекция гепарина натрия (5000 МЕ/кг) для предотвращения развития тромбоза коронарных артерий. Далее крысам проводился инъекционный наркоз посредством внутримышечного введения золетила-100 (Virbac, Франция) в дозировке 0,3 мл/кг с предварительной седацией 2% ксилазином (Alfasan, Нидерланды) за 15 мин до эвтаназии. Хирургические инструменты и операционное поле подвергались стандартными мерам асептики; необходимое для процедуры изоляции оборудование подвергалось дополнительной стерилизации в УФ-боксе.
После эвтаназии грудная клетка животных немедленно вскрывалась, сердце промывалось охлаждённым (15-16 °C) 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислотой (HEPES)-буфером (табл. 2) и помещалось на аппарат Лангендорфа, где подвергалось ретроградной перфузии через аорту со скоростью 3,0-3,5 мл/мин при температуре 35 °C и непрерывной подаче 100% О2.
Изоляция кардиомиоцитов выполнялась посредством метода, подробно описанном в работе Х. Butova и соавт. [12]. На первом этапе перфузии сердце промывалось в течение 5 мин HEPES-буфером с добавлением гепарина натрия (10 МЕ/мл раствора) для очищения коронарных сосудов от крови и стабилизации сердечного ритма изолированного сердца (~80-110 уд./мин).
На следующем этапе проводили снижение возбудимости и ингибирование сократительной активности сердца посредством перфузии гиперкалиевым HEPES-буфером с номинальным содержанием Са2+ (табл. 2). Перфузия данным раствором продолжалась в течение 10 мин с момента полной остановки сокращений изолированного сердца при увеличенной скорости потока перфузионного раствора (до 3,5-4,0 мл/мин).
Далее следовала процедура расщепления межклеточного каркаса посредством перфузии раствором, содержащим комбинацию коллаген-литических ферментов: коллагеназы II активностью ~305 МЕ/мг (Worthington, США) и протеазы XIV активностью ~3,5 МЕ/мг (Sigma Aldrich, США) (см. табл. 2). Ферментативное переваривание сердца можно условно подразделить на 4 этапа. На первом этапе посредством ретроградной перфузии на аппарате Лангендорфа в желудочковые и предсердные камеры подаётся композиция: коллагеназа II 0,8 мг/мл и протеаза XIV 0,06 мг/мл. Спустя 2 мин после начала ретроградной перфузии изолированного сердца ферментативным раствором в предсердные камеры начинает дополнительно подаваться раствор, содержащий 1,0 мг/мл коллагеназы II и 0,06 мг/мл протеазы XIV, при помощи инсулинового шприца. Такая комбинированная перфузия продолжается вплоть до появления начальных признаков разрушения межклеточного каркаса: изменение цвета эпикардиальной поверхности и появление вязких капель.
После этого сердце перемещалось в специальную чашку Петри, содержащую ферментативный раствор с 0,9 мг/мл коллагеназы II и 0,06 мг/мл протеазы XIV, где выполнялась процедура ферментативного переваривания посредством внутрижелудочковых инъекций (со скорость 4,0-4,5 мл/мин) при температуре 35 °C и непрерывной подаче 100% О2. Для поддержания перфузионного давления все инъекции выполнялись в одну и ту же перфорацию, а аорта и сосуды предсердий плотно фиксировались лигатурами. Перфузия продолжалась до появления признаков полного разрушения межклеточного каркаса.
На следующем этапе предсердия отрезались и подвергались дополнительному перевариванию с 1,0 мг/мл коллагеназы II и 0,06 мг/мл протеазы XIV (со скоростью 4,5-5,0 мл/мин) при температуре 35 °C и непрерывной подаче 100% О2 в течение 15-20 мин. После этого ткань предсердий подвергалась механическому измельчению, фильтрации, осаждению посредством центрифугирования в течение 2 мин при 7×g (200 оборотов в мин) в ингибирующем буфере, содержащим бычий сывороточный альбумин (0,5%) (см. табл. 2) и постепенному подъёму внеклеточной концентрации Ca2+ до физиологических значений (1,8 мМ).
Готовая суспензия изолированных кардиомиоцитов хранилась в HEPES-содержащем буфере Тироде (табл. 3) при комнатной температуре. Для предотвращения межклеточной адгезии пробирки с суспензиями располагались под углом 45°. Качество суспензии изолированных кардиомиоцитов оценивалась визуально с использованием светового микроскопа PrimoStar (Carl Zeiss, Германия) на увеличении 10× по следующим признакам: превалирующее количество кардиомиоцитов чёткой палочковидной формы, с выраженной поперечно-полосатой исчерченностью и отсутствием спонтанных сокращений. Далее суспензия разделялась на равные части по количеству групп исследуемых препаратов. До начала измерения магния в каждой суспензии выполнялась проверка жизнеспособности кардиомиоцитов. Для этого оценивали динамику укорочения-расслабления саркомеров при механически ненагруженных сокращениях кардиомиоцитов при задании внешней электрической стимуляции 1 Гц на специализированном аппаратно-программном комплексе IonOptix (IonOptix Corporation, United States). Суспензии, включённые в исследование, обладали соответствующей внешней стимуляции ритмической активностью с медианными значениями амплитуды укорочения саркомеров в пределах 7-10% от конечно-диастолической длины без пролонгации скоростей укорочения и расслабления. Репрезентативные фотографии кардиомиоцитов и графики с функциональным контролем кардиомиоцитов в каждой группе представлены на рис. 1.
Визуализация ионизированного внутриклеточного магния — [Mg2+]i в цитозоле кардиомиоцитов выполнялась при помощи красителя Mag-Fluo-4 AM (Invitrogen, США). Краситель в концентрации 5,0 мкМ и 0,1% Pluronic® F-127 (AAT Bioquest, Inc., США) добавлялся к суспензии клеток в HEPES-содержащем буфере Тироде с концентрацией CaCl2 1,8 мМ на 20 мин при 37 °С. Так как краситель Mag-Fluo-4 чувствителен к ионам Ca2+, далее проводилось удаление надосадочной жидкости, содержащей остатки неутилизированного красителя, и замена раствора на HEPES-содержащий буфер Тироде с 0 мМ CaCl2, в котором суспензия инкубировалась при комнатной температуре ещё 20 мин для достижения полной деэстерификации эфиров АМ перед измерением флюоресценции.
Регистрация изменения [Mg2+]i выполнялось во время электрической стимуляции кардиомиоцита при помощи системы лазерной сканирующей конфокальной микроскопии LSM 710 и программного обеспечения Zen 2009 (Carl Zeiss, Германия). В оптическом канале на изображении кардиомиоцита выбирался узкий регион интереса (3 пикселя высотой, 200-500 пикселей длиной), ориентированный вдоль продольной оси клетки. Указанные размеры региона интереса обусловлены необходимостью достижения временной дискретизации в пределах 1-3 мс в ходе линейного сканирования выбранного участка, что позволило осуществлять измерения флюоресценции в режиме реального времени.
Для возбуждения флюорофора применяли аргоновый лазер с длиной волны 488 нм. Регистрацию сигнала [Mg2+]i проводили в оптическом канале 493-517 нм в HEPES-содержащем буфере Тироде с 0 мМ CaCl2.
Испытания растворов на эффект концентрации ионов магния в цитозоле кардиомиоцитов выполнялись по слепому методу. Тестируемые растворы исследовали в одинаковых пробирках, при этом композиция действующих веществ в каждом из тестируемых растворов была засекречена до получения результатов в целях корректности проведения исследования. Поскольку пробы 2, 3, 5 изменяли рН HEPES-содержащего буфера Тироде, они были исключены из дальнейшего эксперимента. В рамках испытаний кардиомиоциты инкубировались с исследуемыми растворами в течение 30 мин.
Ввиду того, что действующее вещество проб препаратов было растворено в HEPES-содержащем буфере Тироде с 1,8 мМ CaCl2, инкубация суспензии кардиомиоцитов начиналась за 10 мин до начала протокола окрашивания. Загрузка красителя выполнялась по стандартному протоколу, после чего выполнялась регистрация [Mg2+]i в условиях, имитирующих нормомагниемию (при 1 мМ [Mg2+]ex) в течение 10 мин. Таким образом, суммарное время инкубации кардиомиоцитов при полной концентрации препарата составляло 30 мин, тогда как время нахождения предварительно обработанных в HEPES-содержащем буфере Тироде с 0 мМ CaCl2 не превышало 30 мин. В качестве контрольной группы выступала интактная суспензия предсердий, концентрация [Mg2+]i в которых регистрировалась при 1 мМ [Mg2+]ex. Измерения проводили при частоте электрической стимуляции 1 Гц (генератор MyoPacer, Ionoptix, США) при температуре раствора 30 °С. Анализ содержания ионов Mg2+ в цитозоле кардиомиоцитов предсердий оценивалось с использованием программного пакета Fiji ImageJ (US National Institutes of Health, США).
Статистическая обработка результатов проводилась в программном пакете SPSS 16.0. Данные, характеризующие физико-химические свойства препаратов, представлены в виде среднего значения и стандартного отклонения. Результаты экспериментов на кардиомиоцитах представлены как медиана и межквартильный интервал; контроль vs. № раствора, тест Крускалла—Уоллиса, p <0,05.
Таблица 1. Состав исследуемых растворов
Номер пробы | Состав |
1 | Модельная водная система с соотношением Mg2+:Asp=1:4 |
2 | Модельная водная система с соотношением Mg2+:Asp=1:4 с добавлением пиридоксина гидрохлорида (витамина B6) |
3 | Модельная водная система с соотношением Mg2:Asp:Citr=1:2:1 |
4 | Раствор фармацевтической субстанции "Магния аспарагинат", 0,82٪ |
5 | Раствор фармацевтической субстанции "Магния аспарагинат", 0,82٪ c добавлением пиридоксина гидрохлорида (витамина B6) |
6 | Лекарственный препарат "КМА" |
7 | Модельная водная система с соотношением Mg2+:Asp=1:2,5 |
8 | Модельная водная система с соотношением Mg2+:Asp=1:2,5 с добавлением пиридоксина гидрохлорида (витамина B6) |
9 | Модельная водная система с соотношением Mg2+:Citr=1:1,5 |
10 | Модельная водная система с соотношением Mg2+:Asp:Citr=1:1:1 |
КМА — калия магния аспарагинат, Asp — аспарагинат, Mg2 — катион магния, Citr — цитрат | |
Таблица 2. Компоненты растворов, используемых в протоколе получения одиночных кардиомиоцитов
Компонент | HEPES-буфер | Гиперкалиевый HEPES-буфер с номинальным содержанием Ca2+ | Ферментный раствор | Ингибирующий буфер |
Натрия хлорид, мМ | 140,00 | 115,00 | 115,00 | 115,00 |
Калия хлорид, мМ | 5,40 | 14,00 | 14,00 | 14,00 |
Mагния сульфат, мМ | 1,20 | 1,20 | 1,20 | 1,20 |
HEPES, мМ | 10,00 | 10,00 | 10,00 | 10,00 |
Таурин, мМ | 20,00 | 20,00 | 20,00 | 20,00 |
Аденозин, мМ | 5,00 | 5,00 | 5,00 | 5,00 |
D-глюкоза, мМ | 11,10 | 11,10 | 11,10 | 11,10 |
ЭДТА, мМ | – | 0,30 | – | – |
Кальция хлорид, мМ | 1,00 | 0,05 | 0,025 | 0,025 |
Коллагеназа II, мг/мл | – | – | 0,80 | – |
Протеаза XIV, мг/мл | – | – | 0,06 | – |
Бычий сывороточный альбумин, мг/мл | – | – | – | 5,00 |
pH с добавлением гидроксида натрия при 35 °C | 7,35 | 7,15 | 7,35 | 7,35 |
ЭДТА — этилендиаминтетрауксусная кислота, HEPES — 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота | ||||
Таблица 3. HEPES-содержащий раствор Тироде
Компонент | Концентрация, мМ |
Натрия хлорид | 140,0 |
Калия хлорид | 5,4 |
Магния сульфат | 1,0 |
HEPES | 10,0 |
D-глюкоза | 11,1 |
Кальция хлорид | 1,8 |
pH 7,35 с добавлением гидроксида натрия при температуре 30 °С, 100٪ O2 в течение 30 мин перед калибровкой pH, HEPES — 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота | |
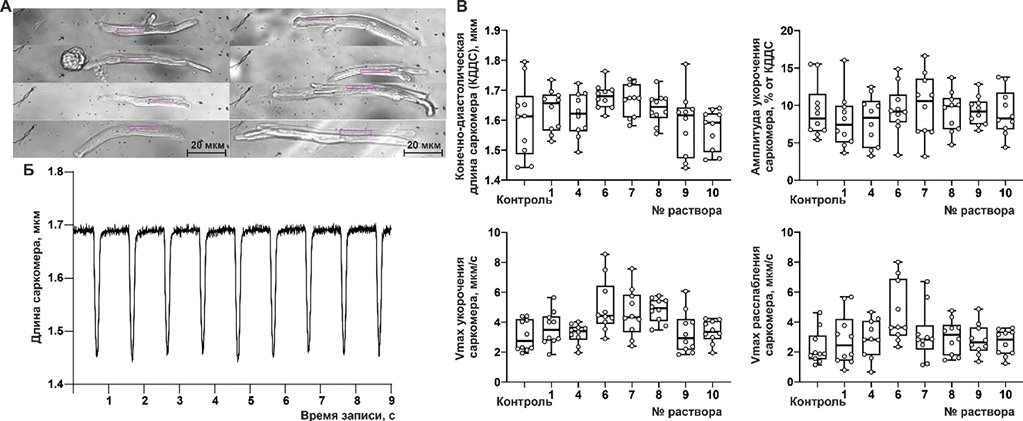
КДСС — конечно-диастолическая длина саркомера, v — скорость
Рисунок 1. Функциональный контроль изолированных кардиомиоцитов предсердий крыс для тестирования [Mg2+]i в цитозоле. A — репрезентативные фотографии изолированных кардиомиоцитов, ×40. Рамкой обозначена зона измерения динамики саркомеров. Б — репрезентативная запись укорочения-расслабления саркомеров кардиомиоцита предсердий. В — Оцениваемые параметры укорочения-расслабления саркомеров в частях суспензии, разделённой для испытания препаратов.
Результаты
В табл. 4 представлены рН, осмоляльность исследуемых растворов магния, коэффициент перераспределения (D, %) в хлороформ и бутанол, показатель диффузии (ΔС, %).
Показано, что в ЛП "КМА" — препарате промышленного производства — осмоляльность была существенно выше за счёт большего количества изначально вводимого гидроксида калия. Следовательно, сделано предположение, что и активная концентрация ионов магния должна быть более низкой.
Согласно расчётам, на основе данных, полученных из инструкции по применению, препарат "KMA" содержит 0,058M аспарагината калия и 0,027 аспарагината магния. Ионная сила раствора и активная концентрация ионов магния составили 0,139М и 0,006М, соответственно.
Перераспределение в хлороформ составляет от 3,4 до 10,1% (табл. 4). Минимальную долю перераспределения (3-4%) имели пробы 4, 6, 9. Пробы 4 и 10 не перераспределились в бутанол; минимальное перераспределение в бутанол имели пробы 1 и 9. По трём критериям: распределению в бутанол, хлороформ и прохождению через лецитиновый фильтр наилучшие результаты имели пробы 1 и 7.
Для изучения действия препаратов на восполнение внутриклеточного дефицита магния было проведено их тестирование на изолированных кардиомиоцитах предсердий интактных животных в условиях, имитирующих нормомагниемию, в остром эксперименте после 30-минутной инкубации суспензии клеток с действующим веществом. Результаты представлены на рис. 2.
Обнаружено, что пробы 1 и 4 не оказывали влияния на уровень цитозольного [Mg2+]i. Действующее вещество пробы 10 оказывало наименьший эффект среди тестируемых образцов, повышая [Mg2+]i на ~45% относительно значений контрольного уровня, однако инкубация с ним приводила к увеличению дисперсии значений в выборке по сравнению с группой контроля в 1,6 раз. В свою очередь, это может косвенно указывать на разную чувствительность кардиомиоцитов в выборке к компонентам препарата.
30-минутная инкубация с препаратом 6 приводила к увеличению уровня цитозольного [Mg2+]i на ~71% относительно значений контрольной группы. Наибольший эффект был отмечен для препаратов 7, 8 и 9. 30-минутная инкубация с препаратом 7 приводила к повышению цитозольного [Mg2+]i на ~115%, 8 — на ~128% и 9 — на ~90% относительно значений контрольного уровня.
Таблица 4. Физико-химические свойства исследуемых растворов
Проба | Состав | рН | Осмоляльность | Коэффициент перераспределения D, % n=3 | Показатель диффузии ΔС, ٪ n=3 | |
бутанол | хлороформ | |||||
1 | Mg2+:Asp=1:4 | 7,5±0,1 | 174±2 | 2±0,2 | 8,9±0,3 | 11±2 |
4 | Mg2+:Asp=1:2 | 6,4±0,1 | 55±2 | 0 | 3,4±0,1 | 8±1 |
6 | Mg2+:Asp=1:4 | 6,8±0,1 | 280±2 | 6,7±0,1 | 3,9±0,2 | 5±1 |
7 | Mg2+:Asp=1:2,5 | 7,3±0,1 | 100±2 | 6,7±0,2 | 10,1±0,3 | 9±2 |
8 | Mg2+:Asp=1:2,5 (+ пиридоксин гидрохлорид) | 7,6±0,1 | 102±2 | 7,8±0,1 | 7,9±0,2 | 5±1 |
9 | Mg2+:Citr=1:1,5 | 6,7±0,1 | 97±2 | 1,1±0,1 | 3,4±0,2 | 7±1 |
10 | Mg2+:Asp:Citr=1:1:1 | 6,4±0,1 | 115±2 | 0 | 5,6±0,1 | 2±1 |
Данные представлены в виде: M (cреднее)±m (среднеквадратичное отклонение), Asp — аспарагинат, Citr — цитрат | ||||||
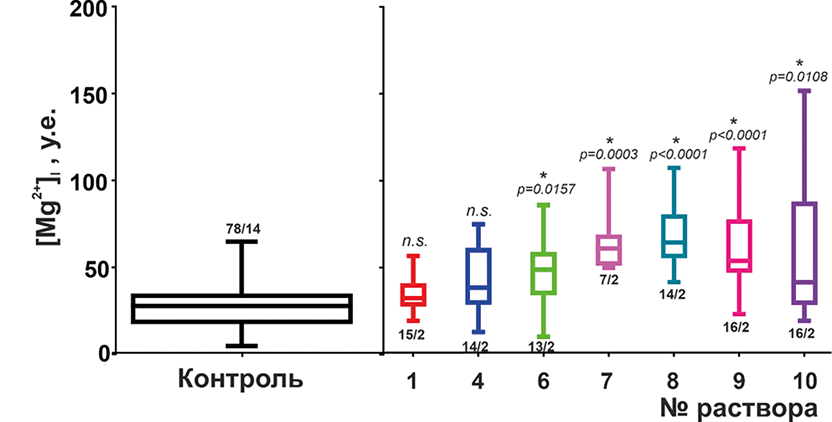
Рисунок 2. Содержание Mg2+ в цитозоле кардиомиоцитов до и после инкубации с тестируемыми препаратами в условиях, имитирующих нормомагниемию. n/N в каждой группе указано на рисунке.
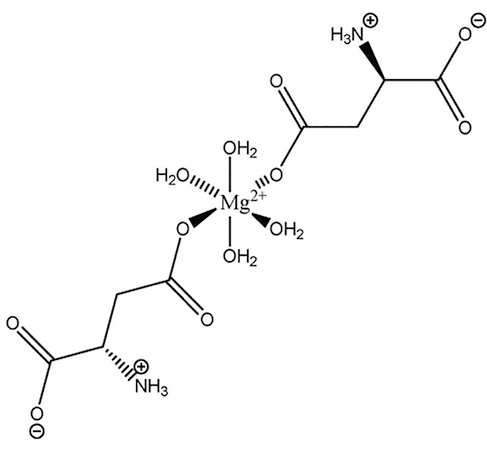
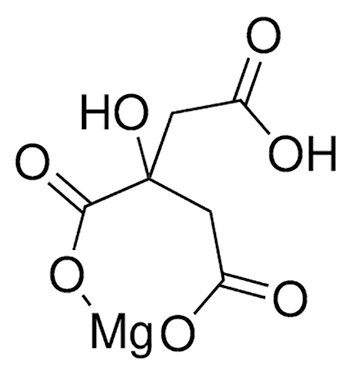
Рисунок 3. Строение нейтральных комплексных соединений магния с (А) аспарагинат-ионом (Mg2+:Asp=1:2) и (Б) цитрат ионом (Mg2+:Citr=1:1).
Обсуждение
Авторы полагают, что ионная сила раствора способна оказывать влияние на внутриклеточную биодоступность магния. Согласно проведенным расчётам, в препарате "КМА" активная концентрация ионов магния в 4,5 раза меньше, чем заданная концентрация.
Кроме того, на биодоступность магния из ЛП "КМА" влияет тип образующегося комплексного соединения магния. Комплексные соединения магния с разными лигандами классифицируются как катионные, нейтральные и анионные [13]. Согласно работе [14], биорелевантными свойствами обладают комплексы нейтрального и анионного типа. Однако экспериментальные методы оценки биодоступности того или иного комплексного соединения доказательны, если они соотносятся с предварительно проведёнными теоретическими расчётами и обобщениями.
Нейтральное комплексное соединение образуется при мольном соотношении Mg2+: Asp = 1:2, при этом положительный заряд иона магния (2+) компенсируется за счёт двух аспарагинат-ионов с зарядом (1-).Это соотношение реализуется в фармацевтической субстанции "магния аспарагинат" (проба 4), в пробах 7 и 8. Строение такого комплекса представлено на рис. 3, А. Анионные комплексы образуются в том случае, если суммарный заряд лигандов превышает заряд ионов магния (+2), что достигается за счёт превышения мольного соотношения 1:2. Например, в пробах 1, 6. В пробах 9 и 10 присутствует цитрат-ион, который является анионом трёхосновной карбоновой кислоты. Известно, что при соотношении Mg2+: Citr, равное 1 к 1, образуется нейтральное комплексное соединение (рис. 3, Б), а при избытке цитрат-иона может образовываться комплекс анионного типа.
В пробе 7 уменьшение концентрации ионов калия закономерно, поскольку меньшее количество аспарагиновой кислоты содержится в растворе.
Проба 8 отличается от пробы 7 тем, что в неё был дополнительно введён ЛП пиридоксина гидрохлорид (витамин B6). В ранее проведённой авторами работе [9] показано положительное влияние пиридоксина гидрохлорида на экстракцию комплексов магния в органические растворители и диффузию через лецитиновый фильтр. Эти результаты коррелируют с данными других авторов по восполнению дефицита магния из разных ЛП, определяемых в физиологических экспериментах с лабораторными животными [10]. Важно отметить, что в ранее опубликованных работах оценка восполнения дефицита магния проводилась в экспериментах по изучению изменения содержания магния в крови лабораторных животных, однако особый интерес в отношении коррекции именно внутриклеточного дефицита данного элемента представляют эксперименты с кардиомиоцитами.
Исходя из анализа физико-химических свойств синтезированных комплексных соединений магния и их тестирования на кардиомиоцитах, наиболее перспективным в отношении восполнения внутриклеточного магния оказался препарат, в котором соотношение магния к аспарагиновой кислоте составило как 1 к 2,5 (пробы 7 и 8). С одной стороны, проба 7 близка по композиции к пробе 4, но в эксперименте с кардиомиоцитами она оказалась неэффективной по отношению к восполнению цитозольного магния. Это можно объяснить тем, что концентрация биорелевантного комплекса магния была ниже (при прочих равных условиях) и это связано с диссоциацией нейтральной формы комплекса в водной среде:
[MgL2]↔[MgL1]+ + L- (6),
где L — аспарагиновая кислота.
При небольшом избытке аспарагиновой кислоты (пробы 7 и 8) равновесие смещается влево и, следовательно, концентрация биорелевантного комплекса магния будет выше.
С другой стороны, проба 7 близка по композиции к ЛП "КМА", однако за счёт снижения содержания калия в системе авторами достигнуто улучшение ряда физико-химических показателей: рН системы более физиологичный, выше активная концентрация ионов магния и выше концентрация комплексного соединения, выше липофильность образующегося комплексного соединения магния и, как следствие, лучше показатели, коррелирующие с биодоступностью магния, а именно перераспределение в хлороформ и диффузия через "лецитиновый" фильтр. Кроме того, одновалентный катион калия, в отличие от двухвалентного катиона магния, имеет более простой механизм активного транспорта внутрь клетки, наравне с более устойчивыми механизмами поддержания его гомеостаза [15][16], поэтому в целях дотации магния в ЛП совершенно необязательно дополнительно вводить катион калия, существенно изменяющий свойства образующегося комплексного соединения.
Результаты исследования открывают новые возможности для коррекции внутриклеточного дефицита магния в клинической практике при нарушениях сердечного ритма, в частности, при ФП. Субанализ результатов исследования ARIC и Фремингемской когорты продемонстрировал убедительную взаимосвязь между низким содержанием сывороточного магния и увеличением риска развития ФП [5, 6]. В выводах метаанализа, включавшего только двойные слепые, плацебо-контролируемые рандомизированные клинические исследования, W. J. Gu и соавт. сообщили о снижении частоты возникновения послеоперационной ФП на 36% в результате целенаправленной коррекции гипомагниемии [17]. Магний оказывает существенное влияние и на успешность восстановления синусового ритма. В многоцентровом исследовании [18], в котором изучалось влияние профилактического внутривенного введения магния на эффективность ибутилида при восстановлении синусового ритма у больных с ФП, продемонстрировано увеличение успешности медикаментозной кардиоверсии на 19% (р=0,040) в группе дополнительного введения магния, а также уменьшение времени восстановления синусового ритма на 34% (p=0,045). Аналогичные данные получены и для дофетилида, когда дополнительное внутривенное введение магния увеличило шанс на восстановление синусового ритма при медикаментозной кардиоверсии более чем в 2 раза [19]. Для понимания клинической значимости содержания магния в крови представляется важной работа, проведённая N. Markovits и соавт. [20]. При анализе когорты, состоящей из 162 162 пациентов, установлено, что в долгосрочном периоде наблюдения (>90 дней) риск ФП был значительно выше у пациентов с лёгкой, умеренной или тяжёлой (≤1,9 мг/дл) гипомагниемией, причём увеличение риска развития аритмии обратно пропорционально содержанию магния в сыворотке крови. Однако в краткосрочном периоде (<90 дней) аналогичной зависимости выявить не удалось, что во многом позволяет приблизиться к объяснению не всегда однозначных клинических данных относительно применения магния в лечении ФП. По-видимому, длительный период формирования гипомагниемии, сложные механизмы транспорта иона во внутриклеточную среду, а также многоэтапность в реализации его электрофизиологических эффектов не всегда могут представлять оправданной тактику одномоментного создания высоких концентраций магния при ФП. Результаты исследования LOMAGHI ещё раз подчеркнули, что низкие дозы вводимого магния сопоставимы по эффективности с высокими в раннем лечении ФП с быстрым желудочковым ответом, но в то же время продемонстрировали значительно лучший профиль безопасности [21]. С учётом того, что введение высоких доз магния (сернокислая магнезия) является патофизиологически оправданным лишь при желудочковых нарушениях сердечного ритма [22], экспериментальные аспекты, представленные в настоящей работе, ещё раз подчеркивают важность выбора ЛП с определённым составом и свойствами для решения непростой задачи восполнения внутриклеточного дефицита магния при наджелудочковых аритмиях. Данные, полученные в серии авторских экспериментов, подтверждают, что применяемые в практике препараты на основе комплексов магния с витамином B6, как правило, имеют избыток лиганда, что способствует образованию прочных комплексных соединений, затрудняющих восполнение внутриклеточного дефицита магния. Применение такого соединения, как оротат магния, в большей степени направлено на восполнение внеклеточного (плазменного) дефицита магния, в то время как аспарагинат магния в найденном соотношении магния к аспарагиновой кислоте 1 к 2,5 экспериментально подтвердил возможность восполнения внутриклеточного дефицита данного элемента за счёт формирования липофильного комплексного соединения. Стоит отметить, что образующиеся комплексные соединения магния с аспарагиновой кислотой достаточно стабильны, но в то же время не затрудняют внутриклеточный транспорт иона [9][14][16]. В целях поддержания оптимальной ионной силы раствора и концентрации магния в препарате от дополнительного введения катионов калия в общую систему целесообразно воздержаться.
Ограничения исследования
При интерпретации экспериментальных данных, полученных на изолированных кардиомиоцитах, следует учитывать фундаментальные межвидовые различия в особенностях функционирования сердечно-сосудистой системы человека и мелких млекопитающих. Кроме того, эксперименты, проведенные на изолированных кардиомиоцитах, были выполнены на крысах одного пола (самцы), поэтому в данной статье не исследованы возможные половые различия. Также следует упомянуть, что для оценки содержания ионов Mg2+ в цитозоле применялся флюоресцентный индикатор, который пусть в минимальной степени, но может оказывать ряд эффектов на изменение физиологии кардиомиоцита.
Заключение
В работе представлен методологический подход к анализу комплексных соединений магния для восполнения внутриклеточного дефицита, включающий тип комплексного соединения, его концентрацию, липофильность, а также осмоляльность исходной системы.
Согласно экспериментальным данным, полученным в ходе физико-химического тестирования препаратов магния и экспериментов, проведённых на кардиомиоцитах лабораторных животных, наиболее перспективной в отношении восполнения внутриклеточного магния оказалась система на основе аспарагината магния, в которой соотношение магния к аспарагиновой кислоте составляет 1 к 2,5. Избыток калия в ряде препаратов, в частности, в КМА, повышает ионную силу раствора и уменьшает активную концентрацию ионов магния, что негативно сказывается на биодоступности последнего элемента. Целесообразно оптимизировать состав существующих препаратов, направленных на восполнение дефицита магния, уменьшая количество катионов калия в растворе, в случае их наличия в общей системе.
1. Фармакопейная статья Tabulettae "Asparcam" 42-1701-97.
Список литературы
1. Jahnen-Dechent W, Ketteler M. Magnesium basics. Clin Kidney J. 2012;5(Suppl 1): i3-i14. DOI:10.1093/ndtplus/sfr163.
2. Maguire ME, Cowan JA. Magnesium chemistry and biochemistry. Biometals. 2002;15(3):203-10. DOI:10.1023/a:1016058229972.
3. Swaminathan R. Magnesium metabolism and its disorders. Clin Biochem Rev. 2003:24(2):47-66.
4. de Baaij JH, Hoenderop JG, Bindels RJ. Magnesium in man: implications for health and disease. Physiol Rev. 2015;95(1):1-46. DOI:10.1152/physrev.00012.2014.
5. Khan AM, Lubitz SA, Sullivan LM, et al. Low serum magnesium and the development of atrial fibrillation in the community: the Framingham Heart Study. Circulation. 2013;127(1):33-8. DOI:10.1161/CIRCULATIONAHA.111.082511.
6. Misialek JR, Lopez FL, Lutsey PL, et al. Serum and dietary magnesium and incidence of atrial fibrillation in whites and in African Americans-Atherosclerosis Risk in Communities (ARIC) study. Circ J. 2013;77(2):323-9. DOI:10.1253/circj.cj12-0886.
7. Божко Я. Г., Архипов М.В., Белоконова Н.А., Киселева Д.В. Клиникометодологические аспекты в диагностике дефицита магния у пациентов с пароксизмальной фибрилляцией предсердий. Казанский медицинский журнал. 2019;100(2):197-203. DOI:10.17816/KMJ2019-197.
8. Божко Я. Г., Архипов М.В., Белоконова Н.А. Изучение влияния ингибиторов протонной помпы на развитие гипомагниемии у пациентов с пароксизмальной формой фибрилляции предсердий на фоне вегетативной дисфункции синусового узла. Рациональная фармакотерапия в кардиологии. 2019;15(6):840-6. DOI:10.20996/1819-6446-2019-15-6-840-846.
9. Белоконова Н. А., Медведева О. М., Божко Я. Г., Архипова М. В. Физикохимические свойства лекарственных препаратов магния. Вестник Воронежского государственного университета. Серия: Химия. Биология. Фармация. 2024;(1):5-13.
10. Иежица И.Н., Кравченко М.С., Харитонова М.В. и др. Сравнительная биодоступность некоторых органических солей магния и магнийсодержащих препаратов в условиях алиментарной гипомагнезиемии. Вестник Волгоградского государственного медицинского университета. 2007;(4):39-41.
11. Белоконова Н.А., Ермишина Е.Ю., Наронова Н.А., Бородулина Т.В. Диффузия минерального состава молочных смесей через полупроницаемую мембрану в сравнении с грудным молоком и модельным раствором. Известия вузов. Прикладная химия и биотехнология. 2018;8(1):115-21.
12. Butova XA, Myachina TA, Khokhlova AD. A combined Langendorff-injection technique for simultaneous isolation of single cardiomyocytes from atria and ventricles of the rat heart. Methods X. 2020;8:101189. DOI:10.1016/j.mex.2020.101189.
13. Попков В.А., Пузаков С.А. Общая химия. ГЭОТАР-Медиа; 2009.
14. Case DR, Zubieta J, P Doyle R. The Coordination Chemistry of Bio-Relevant Ligands and Their Magnesium Complexes. Molecules. 2020;25(14):3172. DOI:10.3390/molecules25143172.
15. Duchatelle-Gourdon I, Hartzell HC, Lagrutta AA. Modulation of the delayed rectifier potassium current in frog cardiomyocytes by beta-adrenergic agonists and magnesium. J Physiol. 1989;415:251-74. DOI:10.1113/jphysiol.1989.sp017721.
16. Yogi A, Callera GE, Tostes R, et al. Bradykinin regulates calpain and proinflammatory signaling through TRPM7-sensitive pathways in vascular smooth muscle cells. Am J Physiol Regul Integr Comp Physiol. 2009;296(2): R201-7. DOI:10.1152/ajpregu.90602.2008.
17. Gu WJ, Wu ZJ, Wang PF, et al. Intravenous magnesium prevents atrial fibrillation after coronary artery bypass grafting: a meta-analysis of 7 doubleblind, placebo-controlled, randomized clinical trials. Trials. 2012;13:41. DOI:10.1186/1745-6215-13-41.
18. Kalus JS, Spencer AP, Tsikouris JP, et al. Impact of prophylactic i.v. magnesium on the efficacy of ibutilide for conversion of atrial fibrillation or flutter. Am J Health Syst Pharm. 2003;60(22):2308-12. DOI:10.1093/ajhp/60.22.2308.
19. Coleman CI, Sood N, Chawla D, et al; Dofetilide and Intravenous Magnesium Evaluation (DIME) Investigators. Intravenous Magnesium Evaluation (DIME) Investigators. Intravenous magnesium sulfate enhances the ability of dofetilide to successfully cardiovert atrial fibrillation or flutter: results of the Dofetilide and Intravenous Magnesium Evaluation. Europace. 2009;11(7):892-5. DOI:10.1093/europace/eup084.
20. Markovits N, Kurnik D, Halkin H, et al. Database evaluation of the association between serum magnesium levels and the risk of atrial fibrillation in the community. Int J Cardiol. 2016;205:142-6. DOI:10.1016/j.ijcard.2015.12.014.
21. Bouida W, Beltaief K, Msolli MA, et al. Low-dose Magnesium Sulfate Versus High Dose in the Early Management of Rapid Atrial Fibrillation: Randomized Controlled Double-blind Study (LOMAGHI Study). Acad Emerg Med. 2019;26(2):183-91. DOI:10.1111/acem.13522.
22. Hoshino K, Ogawa K, Hishitani T, et al. Successful uses of magnesium sulfate for torsades de pointes in children with long QT syndrome. Pediatr Int. 2006;48(2):112-7. DOI:10.1111/j.1442-200X.2006.02177.x.
Об авторах
Я. Г. БожкоРоссия
Божко Яков Григорьевич, аспирант кафедры терапии ФПК и ПП
Екатеринбург
Н. А. Белоконова
Россия
Белоконова Надежда Анатольевна, заведующий кафедрой общей химии
Екатеринбург
О. М. Медведева
Россия
Медведева Ольга Михайловна, доцент кафедры общей химии
Екатеринбург
К. А. Бутова
Россия
Бутова Ксения Андреевна
Екатеринбург
М. В. Архипов
Россия
Архипов Михаил Викторович, профессор кафедры поликлинической терапии
Екатеринбург
Рецензия
Для цитирования:
Божко Я.Г., Белоконова Н.А., Медведева О.М., Бутова К.А., Архипов М.В. Восполнение внутриклеточного дефицита магния при нарушениях сердечного ритма: в фокусе физико-химические свойства комплексных соединений. Рациональная Фармакотерапия в Кардиологии. 2025;21(2):155-165. https://doi.org/10.20996/1819-6446-2025-3149. EDN: NZEGLS
For citation:
Bozhko Ya.G., Belokonova N.A., Medvedeva O.M., Butova K.A., Arkhipov M.V. Replenishment of intracellular magnesium deficiency in cardiac arrhythmias: focus on the physicochemical properties of complex compounds. Rational Pharmacotherapy in Cardiology. 2025;21(2):155-165. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3149. EDN: NZEGLS

















































