Перейти к:
Диабетическая кардиомиопатия: исключительно осложнение или отдельное малоизученное заболевание?
https://doi.org/10.20996/1819-6446-2025-3150
EDN: MITYPR
Аннотация
Начиная с 70-х годов прошлого столетия предметом изучения специалистов и ученых является специфическое нарушение структуры и функции миокарда при сахарном диабете (СД) — диабетическая кардиомиопатия (ДК), основным клиническим проявлением которой является сердечная недостаточность (СН). Многочисленные исследования демонстрируют высокий риск развития СН у больных сахарным диабетом 2 типа (СД2), а также ухудшение прогноза вышеуказанных заболеваний при сопряженном течении. Так, в популяционном исследовании Kaiser Permanente у пациентов с СД2 моложе 75 лет риск СН был в 3-4 раза выше, чем у пациентов без диабета. Несмотря на накопленный опыт в изучении патологии, ДК множеством специалистов рассматривается как осложнение СД, а не как отдельное состояние, и является предметом споров и дискуссий. В то же время, проводимые исследования все чаще выявляют характерные нарушения функции сердца с особенностями патофизиологии, что дает основание говорить о, возможно, отдельном состоянии, протекающем на фоне СД. К настоящему времени нет общепринятых клинических руководств по диагностике и лечению ДК, в связи с чем существует потребность определения четких и ясных диагностических критериев ДК, что жизненно важно для выявления групп высокого риска развития данной кардиомиопатии. В обзорной статье анализируются данные литературы по изучаемой проблеме, касающиеся терминологии, этиологии, патогенеза и лечения. Систематизация имеющихся знаний, четкая формулировка критериев постановки диагноза позволили бы больше сосредоточиться на поиске новых терапевтических методов.
Ключевые слова
Для цитирования:
Марданов Б.У., Мамедов М.Н. Диабетическая кардиомиопатия: исключительно осложнение или отдельное малоизученное заболевание? Рациональная Фармакотерапия в Кардиологии. 2025;21(3):298-306. https://doi.org/10.20996/1819-6446-2025-3150. EDN: MITYPR
For citation:
Mardanov B.U., Mamedov M.N. Diabetic cardiomyopathy: merely a complication or a distinct understudied disease? Rational Pharmacotherapy in Cardiology. 2025;21(3):298-306. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3150. EDN: MITYPR
Введение
Среди осложнений сахарного диабета (СД), затрагивающих сердечно-сосудистую систему, особое внимание заслуживает поражение структуры и функции сердечной мышцы — так называемая диабетическая кардиомиопатия (ДК). Согласно распространенному определению, ДК — патофизиологическое состояние у больных СД, при котором сердечная недостаточность (СН) возникает при отсутствии ишемической болезни сердца (ИБС), артериальной гипертензии (АГ) и поражения клапанного аппарата сердца [1].
Взаимосвязь между СД и СН, которая является ведущим синдромом ДК, сложна и двунаправленна. Многочисленные исследования демонстрируют ухудшение прогноза вышеуказанных заболеваний при сопряженном течении [2][3]. В популяционном исследовании Kaiser Permanente у пациентов с СД 2 типа (СД2) моложе 75 лет риск СН был в 3-4 раза выше, чем у пациентов без диабета. При этом риск увеличивался практически вдвое для лиц старше 75 лет. СД2, ухудшая прогноз больных с СН со сниженной фракцией выброса (ФВ) левого желудочка (СНнФВ), оказался более опасен для пациентов с СН и сохраненной ФВ (СНсФВ), у которых значимо повышались как смертность, так и риск госпитализаций [4].
Тем не менее, несмотря на накопленный впечатляющий объем знаний в области изучения некоронарогенных заболеваний миокарда, существование кардиомиопатии, приписываемой исключительно СД, было и остается предметом споров, в том числе из-за отсутствия консенсусной формулировки и проблем терминологии. Также нет единого мнения относительно патофизиологических моментов, которые должны подразумеваться при определении ДК или ее классификации, что в сочетании с отсутствием общепринятых диагностических маркеров и методов лечения, специфичных для этого заболевания, ограничивает его общее понимание [1].
Однако исследования, проведенные по ДК, предполагают роль уникальных механизмов патогенеза, отличных от таковых при других заболеваниях сердечно-сосудистой системы, в том числе на фоне СД [4][5]. С этих позиций поиск новых точек медикаментозного воздействия остается актуальным. В настоящем обзоре представлена обновленная систематизированная информация о проблеме ДК.
Методология
В работе были использованы основные данные и выводы из отечественных и англоязычных статей, рекомендаций и исследований, посвященных диагностике и лечению СД, хронической сердечной недостаточности (ХСН), ДК за последние 10 лет. Использовались поисковые термины: «кардиомиопатии», «диабетическая кардиомиопатия», «сердечная автономная нейропатия», «хроническая сердечная недостаточность», «сахароснижающая терапия», «ингибиторы натрий-глюкозного котранспортера 2 типа», «diabetic cardiomyopathy», «cardiac autonomic neuropathy» (поиск на английском языке был сужен). Был собран материал из статей, размещенных в PubMed, eLIBRARY.RU, Cyberleninka. Исследования или статьи, которые не соответствовали теме обзора или не имели отношения к теме обзора, были исключены.
Историческая справка и определение ДК
Впервые структурное поражение миокарда почти у 2/3 больных СД пожилого возраста описал в 1954 г. К. Lundbeck [6]. Но сам термин «диабетическая кардиомиопатия» был предложен S. Rubler и соавт. в 1972 г. после посмертных исследований у больных СД с ХСН [5]. При этом ИБС, АГ, злоупотребление алкоголем и другие заболевания, сопровождающиеся структурными изменениями сердца были исключены как возможные причины. По представлению A. Aneja и соавт., ДК — это проявление СД, которое характеризуется миокардиальной дисфункцией, при отсутствии АГ и структурных изменений сердца, таких, как патология клапанного аппарата или ИБС [7]. A. Lorenzo-Almoros и соавт. дополнили определение ДК тем, что, по их мнению, данная патология характеризуется наличием в большей степени диастолической дисфункции левого желудочка (ЛЖ) [8]. A. Marcinkiewicz и соавт. считают, что ДК — это результат длительного влияния на миокард метаболических нарушений, в основном, связанных с инсулинорезистентностью и сверхэкспрессией резистина, которые развиваются еще на стадии предиабета и способствует формированию и прогрессированию ишемии миокарда [9].
В 2018 г. ассоциация по изучению СН Европейского общества кардиологов признала, что невозможно сформулировать четкое определение ДК [10]. Таким образом, наиболее распространенное определение ДК — «дисфункция миокарда у больных СД, которая возникает при отсутствии других сердечно-сосудистых заболеваний». Тем не менее, прикладное значение данного определения вызывает вопросы, учитывая тот факт, что сложно представить ситуации, при которых СД бы протекал без заболеваний сердечно-сосудистой системы, ИБС и АГ, в частности. По этой причине, некоторые эксперты предложили определять ДК как дисфункцию миокарда, которая не объясняется другими сердечно-сосудистыми или внесердечными заболеваниями, и может быть связана только с СД.
Распространенность и патогенез
На сегодняшний день отсутствует консенсус по определению и критериям диагноза ДК, поэтому сложно сформулировать точную распространенность или частоту возникновения синдрома. Поскольку основным клиническим проявлением ДК является СН, то представляется целесообразным проанализировать ее распространённость. Так, согласно клиническим исследованиям с участием пациентов с СД2 распространенность СН составляет 10-30% [11]. В то же время частота выявления СНнФВ диабетической этиологии (которую можно было бы интерпретировать как ДК) в клинических исследованиях составляла около 1% [12].
Существует двунаправленная взаимосвязь между СД и СН. Известно, что СН влечет за собой активацию ренин-ангиотензин-альдостероновой, симпатического звена вегетативной нервной системы, а также системы натрийуретических пептидов. Первые две увеличивает задержку натрия и воды и активируют печеночный липолиз, липогенез и глюконеогенез, способствуя инсулинорезистентности и, следовательно, диабету. Гипергликемия при диабете, в свою очередь, ответственна за микрососудистые и макрососудистые осложнения. Для макрососудистых осложнений повышение уровня глюкозы в крови вызывает атеросклероз и гибель части кардиомиоцитов, что приводит к ИБС и СНнФВ, в то время как жесткость саркомера и фиброз ответственны за ограничение расслабления ЛЖ и развитие СНсФВ. Воспаление же оказывает заметное влияние на оба механизма [13].
Следовательно, СН при диабете может быть вызвана макроангиопатией с поражением коронарных артерий, вызывающим ишемию миокарда, или первичным поражением сердечной мышцы (кардиомиопатия) [5].
Было предложено множество механизмов для объяснения дисфункции миокарда при ДК, из которых в качестве основных можно выделить:
— нарушения энергетического обмена и кальций-натриевого гомеостаза;
— инсулинорезистентность;
— эндотелиальная дисфункция;
— кардиальная автономная нейропатия [13].
Нарушения энергетического обмена и кальций-натриевого гомеостаза
В нормальных условиях главным источником энергии для миокарда являются свободные жирные кислоты (70%) и глюкоза (30%). Однако, сердце является очень «гибким» метаболическим органом и может менять источники энергии в зависимости от их доступности, в том числе использовать лактат, пируват, глицерин и бета-гидроксибутират в условиях недостаточности кровоснабжения [14]. Данный процесс регулируется циклом Рэндла, в котором ключевым фактором для использования определенного субстрата в сердце является доступность глюкозы: высокий уровень глюкозы в крови снижает скорость окисления свободных жирных кислот, и наоборот. При СН возникают нарушения в выработке энергии на уровне митохондрий. Следовательно, несмотря на повышение уровня свободных жирных кислот и глюкозы (а также их поглощение кардиомиоцитами), они не могут метаболизироваться как свободные жирные кислоты и пируват соответственно, из-за блокирования комплекса пируватдегидрогеназы, что приводит к их накоплению в цитозоле клетки [7]. В результате описанных процессов активируется образование промежуточных метаболитов, которые вызывают нарушения клеточной сигнализации, липотоксичность и глюкозотоксичность. Изменение окисления энергетического субстрата влечет за собой снижение активности цикла Кребса, тем самым снижая соотношение фосфокреатин/аденозинтрифосфат (АТФ). Таким образом, можно представить, что миокард функционирует при СН как «двигатель без топлива», особенно в условиях повышенного спроса на энергетический субстрат [7]. В результате описанных развивается липотоксичность/глюкозотоксичность, которые способствуют дисбалансу кальция, апоптозу и воспалению, что приводит к прогрессированию дисфункции миокарда [15].
Инсулинорезистентность
Миокард при СН даже в отсутствие СД проявляет инсулинорезистентность из-за повышения адренергического тонуса, наличия воспалительных молекул, окислительного стресса и гипоперфузии тканей [16]. Инсулинорезистентность патофизиологически связана с повышенным печеночным липолизом, липогенезом и глюконеогенезом, которые развиваются компенсаторно в кардиомиоцитах в условиях энергетического дефицита [17]. Фактически, инсулинорезистентность является независимым фактором риска смертности у стабильных пациентов с ХСН [16]. Однако неизвестно, улучшает ли снижение инсулинорезистентности прогноз за счет восстановления сократимости миокарда.
Эндотелиальная дисфункция
Патогенетически осложнения СД связаны с эндотелиальной дисфункцией, в первую очередь, через снижение синтеза оксида азота. Ряд сахароснижающих препаратов действуют путем активации фосфонозитид-3-киназы, которая контролирует активность эндотелиальной синтазы оксида азота [18]. При рестриктивном фенотипе СНсФВ левый желудочек не расширен, а скорее гипертрофирован, и характеризуется повышенной жёсткостью. Кардиомиоциты также гипертрофированы, с нормальной саркомерной структурой, но высоким напряжением покоя и реактивным фиброзом (увеличением отложения коллагена среди кардиомиоцитов) [19]. При этом фенотипе в коронарном микрососудистом русле преобладает эндотелиальная дисфункция, вызванная субклиническим воспалением, связанным с сопутствующими заболеваниями, и непосредственно гипергликемией, липотоксичностью и микрососудистым разрежением. Эта эндотелиальная дисфункция влияет на ремоделирование сердца и снижает доступность оксида азота, что, в свою очередь, снижает активность протеинкиназы-G, результатом чего является снижение растяжимости и повышение жесткости кардиомиоцитов за счет гиперфосфорилирования цитоскелетных белков [19].
Кардиоваскулярная автономная нейропатия
На сегодняшний доказано, что кардиоваскулярная автономная нейропатия (КАН) у больных СД приводит к дисбалансу между симпатическими и парасимпатическими нервными волокнами, которые иннервируют сердце и кровеносные сосуды, что приводит к нарушениям в регуляции сердечного ритма и сосудистой динамики. КАН характеризуется тахикардией покоя, постуральной гипотензией, ортостатической брадикардией и ортостатической тахикардией, непереносимостью физических нагрузок, явлениями дыхательной недостаточности, вызванных гипоксией, потерей чувствительности барорецепторов, увеличением частоты бессимптомной ишемии, инфаркта миокарда и снижением уровня выживаемости после инфаркта миокарда и при застойной СН [20].
Достижения в области технологий, основанные на десятилетиях исследований, позволяют объективно определять ранние стадии КАН с использованием тщательного измерения временных и частотных параметров вариабельности сердечного ритма. Ряд исследований с использованием различных методов оценки сообщают о показателях распространенности КАН от 1% до 90% больных СД. Доказано, что КАН может предшествовать развитию воспалительного каскада при СД2, приводя к потере дофаминергического сдерживания в симпатической гиперактивности. КАН играет роль в развитии и прогрессировании обоих фенотипов СН — СНнФВ, СНсФВ у больных СД [19].
Диагностика ДК
Знания о патофизиологии и молекулярно-гуморальных механизмах развития и прогрессирования ДК ограничены, в связи с чем не разработаны четкие диагностические критерии. Вместе с тем, выделены определённые факторы риска развития ДК. К ним относятся длительный СД, плохо контролируемый СД, микрососудистые осложнения СД, диабетическая нефропатия, ретинопатия и нейропатия [12].
В повседневной клинической практике для постановки диагноза ДК можно применять: электрокардиографию (ЭКГ), эхокардиографию, магнитно-резонансную томографию (МРТ) сердца, а также лабораторные исследования.
Электрокардиография
У пациентов с ДК можно выявить определенные изменения электрофизиологии миокарда при помощи стандартной ЭКГ и суточного мониторирования ЭКГ, к которым относятся: удлинение интервала QT, увеличение дисперсии QT и дисперсия интервала Tрeak-Теnd. Данные аномалии реполяризации являются результатом асинхронного движения миокарда и, как сообщается, отражают диастолическую дисфункцию ЛЖ [21]. Однако, стоит отметить, что указанные изменения не являются специфичными, что затрудняет диагностику ДК исключительно на основании ЭКГ.
Эхокардиографическое исследование
Эхокардиография в В-режиме является наиболее часто применяемым методом диагностики ДК. Для оценки функции ЛЖ у больных СД часто используемым критерием является оценка показателя глобальной продольной деформации (global longitudinal strain, GLS). Изменение GLS, вероятно, является первым ультразвуковым признаком доклинической ДК, подтвержденным как при 1-м, так и 2-м типах СД. Теоретически, продольные волокна миокарда более склонны к ишемии и фиброзу, поскольку компенсаторное ремоделирование желудочков может увеличить функцию короткой оси. Метаанализ исследований показал, что трехмерная GLS была на 2,4% ниже у пациентов с диабетом, чем у здоровых лиц, и это наиболее очевидный индикатор трехмерной систолической деформации ЛЖ во всех направлениях. GLS также может использоваться для исключения ДК [22].
Оценка размеров и потока легочных вен, в том числе во взаимосвязи с определением галектина-3 позволяет выявить наличие деформации левого предсердия (ЛП), в то время как характерное для ДК ремоделирование ЛП развивается задолго до изменений ЛЖ.
В 2021 г. A.M. Stanton и соавт. предложили эхокардиографический диагностический критерий ДК, основанный на методе четырех делений. Признавая существование только одного фенотипа (СНсФВ), исследователи считают, что доклиническая стадия дисфункции миокарда (стадия B согласно классификации American College of Cardiology (АСС) и American Heart Association (АНА)) является лучшим временем для диагностики ДК. Для установления диагноза у пациенты должна быть по крайней мере одна из следующих эхокардиографических аномалий: гипертрофия миокарда ЛЖ, определяемая как индекс массы миокарда ЛЖ (ИММЛЖ) >115 г/м2 у мужчин и >95 г/м2 у женщин; индекс объема ЛП ≥34 мл/м2; аномальное соотношение пиковой ранней диастолической скорости притока митрального клапана (E) к ранней диастолической скорости митрального кольца по данным тканевой допплерографии (e’), определяемое как E/e’ ≥13; нарушение GLS (<18%) [23].
Исходя из точки зрения, что интерпретировать результаты эхокардиографии нужно в комплексе с другими клиническими показателями, в 2015 г. исследователи предложили собственные диагностические критерии ДК. Вначале устанавливается один из двух фенотипов ДК, которые должны соответствовать следующим условиям: наличие СД; исключение ИБС, клапанного или врожденного порока сердца; исключение гипертонической болезни. Исходя из этого, диагностический критерий дилатационного/СНнФВ фенотипа должен исключать: миокардиты с помощью эндомиокардиальной биопсии; ФВ ЛЖ <50%, индекс конечно-диастолического объема ЛЖ >97 мл/м2. Критерии рестриктивного/СНсФВ фенотипа должны исключать: инфильтративные заболевания сердца с помощью эндомиокардиальной биопсии; ФВ ЛЖ <50%, индекс конечно-диастолического объема ЛЖ (ИКДОЛЖ) <97 мл/м2; отношение E/e’ >15 или 8< E/e <15 + ИКДОЛЖ >40 мл/м2, либо 8< E/e’ <15 + мозговой натрийуретический пептид (BNP) >200 пг/мл, или 8< E/e <15 + фибрилляция предсердий, либо 8< E/e’ <15 + гипертрофия ЛЖ (ИММЛЖ у женщин >122 г/м2; ИММЛЖ у мужчин >149 г/м2) [24].
Магнитно-резонансная томография
МРТ сердца позволяет более детально и точно визуализировать миокард. Перспективными выглядят попытки комплексной оценки и диагностики ДК при помощи МРТ благодаря его превосходной способности дифференциальной диагностики ишемической атеросклеротической болезни сердца и отсутствию необходимости контрастирования [25].
МРТ-критерием диагноза ДК может рассматриваться выявление микрососудистой дисфункции миокарда при исследовании [10]. Проведение МРТ сердца позволяет выявить изменения подъема максимальной интенсивности сигнала (Max SI) и время до максимальной интенсивности сигнала (TTM), которые являются индикаторами нарушения коронарной микроциркуляции при СД2. Многофакторный регрессионный анализ показывает, что время до максимальной интенсивности сигнала и подъем максимальной интенсивности сигнала независимо связаны с продольной пиковой систолической скоростью деформации (PSSR), что предполагает наличие механической связи между нарушением перфузии миокарда и субклинической дисфункцией миокарда у пациентов с СД2 [10][25].
Что касается случаев СД 1 типа (СД1), то исследователи предлагают при проведении МРТ сердца оценивать индекс резерва миокардиальной перфузии, который может определять диастолическую функцию желудочков и динамические изменения в сердце при СД у лиц в возрасте от 16 до 21 года, поэтому он может быть чувствительным маркером сердечной дисфункции даже у подростков. Однако стоит признать, что крупные исследования с проведением МРТ сердца среди больных с СД1 все еще отсутствуют [26].
Лабораторные маркеры
Учитывая, что основным морфологическим субстратом ДК является дисфункция ЛЖ, в лабораторном скрининге можно использовать общепринятые биомаркеры.
BNP является более чувствительным индикатором диастолической дисфункции, чем высокочувствительный С-реактивный белок, поэтому он (или N-концевой промозговой натрийуретический пептид (NT-proBNP)) тесно связаны с наличием СН и рекомендуются в качестве раннего скрининга на ДК. Этот тезис подтверждают два проспективных рандомизированных контролируемых исследования: новый стандарт (BNP ≥50 пг/мл или NT-proBNP >125 пг/мл) может надлежащим образом способствовать скринингу популяции пациентов с СД высокого риска, чтобы снизить частоту госпитализаций/смерти по сердечно-сосудистым причинам или ХСН. Однако, результаты оценки этих показателей не могут напрямую подтвердить изменения миокарда, поэтому их необходимо оценивать во взаимосвязи с инструментальными методами [27].
Осуществляются попытки поиска новых биомаркеров ДК, в том числе в ходе экспериментальных исследований, например:
- Кардиотрофин 1 — член семейства цитокинов гликопротеина 130, который высвобождается в ответ на окислительный стресс для модуляции гипертрофии, сократимости, фиброза и ишемии, а также сердечного ремоделирования при ДК [28];
- Активин А — член семейства трансформирующего фактора роста бета, высвобождается эпикардиальным жиром для содействия поступлению глюкозы в клетку через фосфорилирование активина;
- Сердечный белок, связывающий жирные кислоты, сердечный цитозольный белок, который транспортирует жирные кислоты в митохондрии для деградации и генерации АТФ;
- N-концевой пропептид проколлагена типа I и матриксная металлопротеиназа-7 (MMP-7): белки, связанные с накоплением и деградацией внеклеточного матрикса.
- Инсулиноподобный фактор роста, связывающий белок-7, модулятор активности рецептора инсулина.
- Некодирующие РНК в последние годы все чаще используются в диагностике различных процессов при СД. Уровни микроРНК lncRNA NKILA повышались в плазме за 6 мес. до установления диагноза ДК у пациентов с СД. LncRNA NKILA — это молекула, способствующая апоптозу кардиомиоцитов и может играть роль в возникновении и развитии ДК, а также рассматриваться в качестве перспективной в диагностике или лечении [29].
Однако необходимы дальнейшие исследования с когортами пациентов с возможной ДК, чтобы оценить не только диагностическую и прогностическую ценность этих и других биомаркеров, определить референсные значения и, таким образом, установить ранние терапевтические стратегии для предотвращения прогрессирования заболевания.
Анализ ранее опубликованных исследований позволил авторам настоящего обзора разработать и предложить алгоритм диагностики ДК (рисунок).
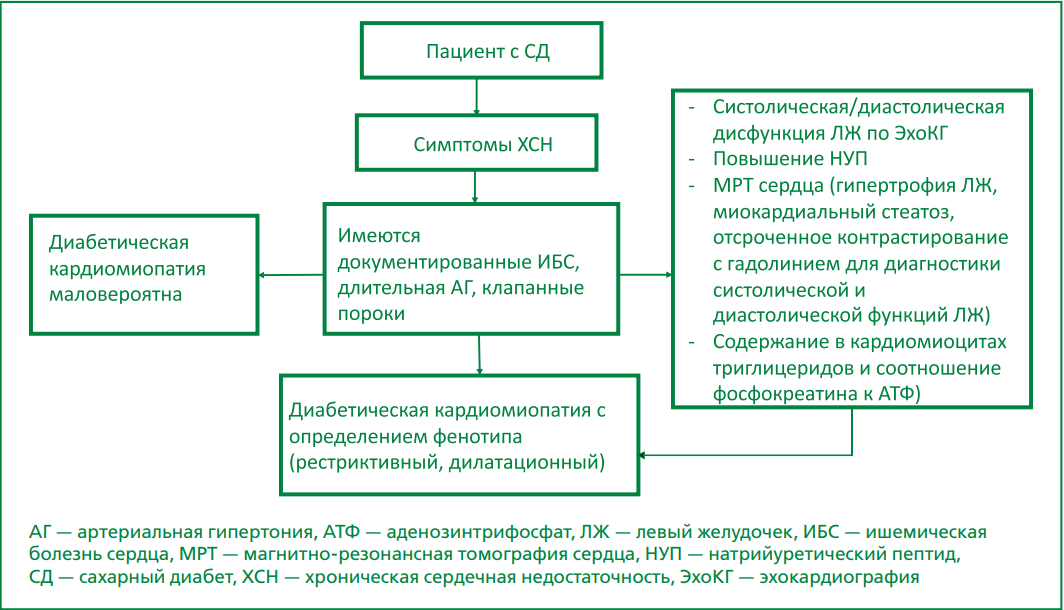
Рисунок. Алгоритм диагностики ДК.
Лечение ДК
На сегодняшний день не существует специфических методов и схем лечения ДК. В идеале лечение ДК должно привести к регрессу патофизиологических нарушений, развивающиеся при этом заболевании. Исходя из этого, методы лечения, обычно используемые у больных с диабетом, могут иметь потенциальную положительную роль при ДК. Однако, стоит помнить, что большинство исследований по изучению эффективности препаратов пока были экспериментальными. Что касается основного синдрома — СН, то после уточнения фенотипов (СНнФВ или СНсФВ) терапия должна осуществляться согласно утвержденным клиническим рекомендациям по лечению ХСН [30].
Ниже рассмотрены основные методы лечения СД2, доступные в настоящее время и их потенциальную роль при ДК.
Метформин
Метформин действует путем ингибирования ферментов митохондриальной дыхательной цепи (комплекс I), снижая выработку АТФ и увеличивая выработку аденозинмонофосфата (АМФ). Таким образом, препарат играет потенциальную роль в увеличении выработки митохондриями энергии. Более того, АМФ активирует АМФ-активируемую протеинкиназу, ингибируя синтез холестерина и липидов и снижая печеночный глюконеогенез [31]. Через АМФ-активируемую протеинкиназу метформин также увеличивает доступность оксида азота, тем самым улучшая эндотелиальную функцию, которая является одним из патогенетических механизмов кардиомиопатии [32].
В настоящее время метформин рассматривается в качестве одного из препаратов первой линии в терапии пациентов с СД2 и СН [31].
Глитазоны и тиазолидиндионы
Росиглитазон, как и другие инсулин-сенсибилизирующие агенты активирует ядерный рецептор PPAR-Ɣ, который оказывает благотворное влияние на локализацию свободных жирных кислот в жировой ткани для восстановления глюкозы как источника энергии клеток. Препараты данного класса способствуют вазодилатации, зависящей от оксида азота, и оказывают положительное влияние на воспаление и ремоделирование сосудов [33].
Однако стоит помнить, что препараты данного класса вызывают задержку натрия и воды, и некоторые исследования показали повышение риска развития СН, в частности, с росиглитазоном и пиоглитазоном [34]. Ввиду сказанного, глитазоны в настоящее время противопоказаны при СН.
Агонисты рецепторов глюкагоноподобного пептида-1
Данные препараты снижают уровень глюкозы в крови за счет увеличения секреции инсулина, снижения глюкагона и снижения массы тела. В клинических исследованиях лираглутид и семаглутид снижали риск комбинированных сердечно-сосудистых событий и смертности, нефатального инфаркта миокарда и нефатального инсульта у пациентов с высоким риском СД2 и анамнезом сердечно-сосудистых событий как средство вторичной профилактики [35].
Ингибиторы дипептидилпептидазы 4
Ингибиторы дипептидилпептидазы 4 оказывают свое гипогликемическое действие за счет увеличения секреции инсулина и снижения секреции глюкагона, как и агонисты глюкагоноподобного пептида-1. Эти агенты продемонстрировали нейтральные сердечно-сосудистые эффекты, за исключением саксаглиптина, который в исследовании SAVOR-TIMI показал 27%-ное увеличение риска госпитализации из-за СН и, следовательно, противопоказан этим пациентам [36]. В то же время последующие исследования не воспроизвели результаты SAVOR-TIMI. Так, по результатам исследования EXAMINE был сформулирован вывод о том, что у пациентов с СД2 и перенесённым острым коронарным синдромом алоглиптин не увеличивал риск СН. У включенных в исследование, в том числе с анамнезом ХСН, не выявлено увеличения риска сердечно-сосудистой смерти и госпитализаций по причине декомпенсации СН [10]. В последующем исследовании TECOS (оценка сердечно-сосудистых исходов на фоне терапии ситаглиптином) сообщалось об отсутствии влияния ситаглиптина на сердечно-сосудистые исходы, включая СН [10].
Ингибиторы натрий-глюкозного котранспортера 2 (иНГЛТ-2)
Данный класс препаратов вызывает ингибирование натрий-глюкозного котранспортера 2 проксимального извитого почечного канальца, тем самым способствуя почечной элиминации глюкозы (глюкозурии) и натрия независимо от секреции инсулина. Эти агенты также отвечают за другие полезные гемодинамические эффекты, такие как увеличение диуреза (диуретический эффект), снижение систолического артериального давления и снижение внутрисосудистого объема, а также снижение преднагрузки и постнагрузки сердца, тем самым улучшая перфузию миокарда кислородом [37]. иНГЛТ-2 также оказывают метаболические эффекты на кардиомиоциты, о которых сообщалось в основном в экспериментальных исследованиях, такие как увеличение кетоновых тел, жирных кислот и глюкагона и снижение внутриклеточного натрия посредством ингибирования натрий-водородного обменника, что может опосредовать противовоспалительный и антиоксидантный эффект [37].
В исследовании EMPA-REG OUTCOME, эмпаглифлозин продемонстрировал снижение первичной комбинированной конечной точки — сердечно-сосудистой смерти, нефатального инфаркта миокарда и нефатального инсульта на 38%, и риска госпитализации по поводу СН на 35% [38]. В недавно завершившемся исследовании EMPA-HEART при помощи МРТ сердца была доказана потенциальная позитивная роль эмпаглифлозина в отношении ремоделировании ЛЖ у 97 пациентов с СД2 и стабильной ИБС. Эмпаглифлозин способствовал уменьшению ИММ ЛЖ, особенно у пациентов с более высокой степенью исходной гипертрофии [39].
В исследовании DAPA-HF изучался эффект дапаглифлозина, добавленного к стандартной терапии для пациентов с СНнФВ (с СД2 или без него). Результаты показали снижение сердечно-сосудистой смертности и госпитализаций по поводу СН, а также улучшение качества жизни в группе активного лечения как при наличии, так и при отсутствии диабета. Отмечено, что дапаглифлозин хорошо переносился, без увеличения частоты отмены лечения. Кроме этого, дапаглифлозин, как и канаглифлозин показали значительные преимущества в отношении функции почек, что особенно важно в связи с высокой частотой сочетания ДК и диабетической нефропатии [40]. Процитированные исследования предопределяют дальнейшее изучение эффектов данных препаратов и, возможно, открывает дверь к потенциальным методам лечения СН и ДК у больных диабетом.
Инсулин
Интенсивное использование инсулина не продемонстрировало улучшения диастолической функции при ДК с фенотипом СНсФВ. Лечение инсулином, далекое от устранения метаболических нарушений диабета, связано с увеличением веса и задержкой натрия и воды [10].
Статины
Принимая во внимание влияние эпикардиального жира, тесно прилегающего к миокарду, на функцию последнего, путем синтеза жирных кислот и провоспалительных цитокинов (лептина, фактора некроза опухоли-альфа, интерлейкина-1-бета и интерлейкина-6), статины могут быть рассмотрены в качестве препаратов для лечения ДК. Как известно, уменьшение эпикардиального жира является одним из плейотропных эффектов статинов [41].
Нейрогуморальные модуляторы
Несмотря на то, что на протяжении длительного времени нейрогуморальные модуляторы (ингибиторы ангиотензинпревращающего фермента, блокаторы рецепторов ангиотензина II, антагонисты альдостерона и β-блокаторы) широко используются в популяции больных СД, нет доказательств о клинической эффективности данных классов препаратов именно у больных с ДК, то однако, новые препараты для лечения СН — ингибиторы альдостероновых рецепторов, ангиотензиновых рецепторов и неприлизина ингибитор, вероятно, будут играть важную роль при терапии ДК с фенотипом СНнФВ в ближайшем будущем [10].
Заключение
Несмотря на многолетнее изучение проблемы, ДК множеством специалистов рассматривается как осложнение СД, а не как отдельное состояние, и является предметом споров и продолжающихся исследований. В то же время проводимые исследования все чаще выявляют характерные нарушения функции сердца с особенностями патофизиологии, что дает основание говорить о, возможном отдельном заболевании, протекающем на фоне СД.
Существует потребность определения четких и ясных диагностических критериев ДК, что жизненно важно для выявления групп высокого риска развития ДК. В свою очередь, осуществляемые попытки систематизации и формулировки критериев постановки диагноза позволят больше сосредоточиться на продолжении поиска новых терапевтических методов. Так, исследования, проведенные с использованием класса препаратов иНГЛТ-2 дают основания рассматривать их в качестве перспективных препаратов в лечении ДК.
Список литературы
1. Караваев П.Г., Веклич А.С., Козиолова Н.А. Диабетическая кардиомиопатия: особенности сердечно-сосудистого ремоделирования. Российский кардиологический журнал. 2019;24(11):42-7. DOI:10.15829/1560-4071-2019-11-42-47.
2. MacDonald MR, Petrie MC, Varyani F, et al. Impact of diabetes on outcomes in patients with low and preserved ejection fraction heart failure: an analysis of the Candesartan in Heart failure: Assessment of Reduction in Mortality and morbidity (CHARM) programme. Eur Heart J. 2008;29(11):1377-85. DOI:10.1093/eurheartj/ehn153.
3. Khan H, Anker SD, Januzzi JL Jr, et al. Heart Failure Epidemiology in Patients With Diabetes Mellitus Without Coronary Heart Disease. J Card Fail. 2019;25(2):78-86. DOI:10.1016/j.cardfail.2018.10.015.
4. Nichols GA, Hillier TA, Erbey JR, Brown JB. Congestive heart failure in type 2 diabetes: prevalence, incidence, and risk factors. Diabetes Care. 2001;24(9):1614-9. DOI:10.2337/diacare.24.9.1614.
5. Сорокина А.Г., Орлова Я.А. Современный взгляд на механизмы развития диабетической кардиомиопатии и возможности их коррекции. Российский кардиологический журнал. 2019;24(11):142-7. DOI:10.15829/1560-4071-2019-11-142-147.
6. Кобалава Ж.Д., Ешниязов Н.Б., Медовщиков В.В. и др. Сахарный диабет 2-го типа и сердечная недостаточность: инновационные возможности управления прогнозом. Кардиология. 2019;59(4):76-87. DOI:10.18087/cardio.2019.4.10253.
7. Aneja A, Tang WH, Bansilal S, et al. Diabetic cardiomyopathy: insights into pathogenesis, diagnostic challenges, and therapeutic options. Am J Med. 2008;121(9):748-57. DOI: 10.1016/j.amjmed.2008.03.046.
8. Lorenzo-Almorós A, Cepeda-Rodrigo JM, Lorenzo Ó. Diabetic cardiomyopathy. Rev Clin Esp. 2020:S0014-2565(20)30025-4. DOI:10.1016/j.rce.2019.10.013.
9. Marcinkiewicz A, Ostrowski S, Drzewoski J, et al. Can the onset of heart failure be delayed by treating diabetic cardiomyopathy? Diabetol Metab Syndr. 2017;9:21. DOI:10.1186/s13098-017-0219-z.
10. Багрий А.Э., Супрун Е.В., Михайличенко Е.С., Голодников И.А. Хроническая сердечная недостаточность и сахарный диабет 2 типа: состояние проблемы. Российский кардиологический журнал. 2020;25(4):3858. DOI:10.15829/1560-4071-2020-3858.
11. Park JJ. Epidemiology, Pathophysiology, Diagnosis and Treatment of Heart Failure in Diabetes. Diabetes Metab J. 2021;45(2):146-57. DOI:10.4093/dmj.2020.0282.
12. Bertoni AG, Tsai A, Kasper EK, Brancati FL. Diabetes and idiopathic cardiomyopathy: a nationwide case-control study. Diabetes Care. 2003;26(10):2791-5. DOI:10.2337/diacare.26.10.2791.
13. Maack C, Lehrke M, Backs J, et al. Heart failure and diabetes: metabolic alterations and therapeutic interventions: a state-of-the-art review from the Translational Research Committee of the Heart Failure Association-European Society of Cardiology. Eur Heart J. 2018;39(48):4243-54. DOI:10.1093/eurheartj/ehy596.
14. Li X, Wu F, Günther S, Looso M, et al. Inhibition of fatty acid oxidation enables heart regeneration in adult mice. Nature. 2023;622(7983):619-26. DOI:10.1038/s41586-023-06585-5.
15. Lambert R, Srodulski S, Peng X, et al. Intracellular Na+ Concentration ([Na+]i) Is Elevated in Diabetic Hearts Due to Enhanced Na+-Glucose Cotransport. J Am Heart Assoc. 2015;4(9):e002183. DOI:10.1161/JAHA.115.002183.
16. Nielsen R, Jorsal A, Iversen P, et al. Heart failure patients with prediabetes and newly diagnosed diabetes display abnormalities in myocardial metabolism. J Nucl Cardiol. 2018;25(1):169-76. DOI:10.1007/s12350-016-0622-0.
17. Obokata M, Reddy YNV, Pislaru SV, et al. Evidence Supporting the Existence of a Distinct Obese Phenotype of Heart Failure With Preserved Ejection Fraction. Circulation. 2017;136(1):6-19. DOI:10.1161/CIRCULATIONAHA.116.026807.
18. Kaur R, Kaur M, Singh J. Endothelial dysfunction and platelet hyperactivity in type 2 diabetes mellitus: molecular insights and therapeutic strategies. Cardiovasc Diabetol. 2018;17(1):121. DOI:10.1186/s12933-018-0763-3.
19. De Keulenaer GW, Brutsaert DL. Systolic and diastolic heart failure are overlapping phenotypes within the heart failure spectrum. Circulation. 2011;123(18):1996- 2004; discussion 2005. DOI:10.1161/CIRCULATIONAHA.110.981431.
20. Нуждина Е.В., Давыдова Е.В. Автономная кардиальная нейропатия и ремоделирование миокарда левого желудочка у пациентов с сахарным диабетом и сопутствующими болезнями системы кровообращения и почек. Профилактическая медицина. 2020;23(1):127-34. DOI:10.17116/profmed202023011127.
21. Jani Y, Kamberi A, Xhunga S, et al. The influence of type 2 diabetes and gender on ventricular repolarization dispersion in patients with sub-clinic left ventricular diastolic dysfunction. Am J Cardiovasc Dis. 2015;5(4):155-66.
22. Silverii GA, Toncelli L, Casatori L, et al. Assessment of left ventricular global longitudinal strain in patients with type 2 diabetes: Relationship with microvascular damage and glycemic control. Nutr Metab Cardiovasc Dis. 2022;32(4):994-1000. DOI:10.1016/j.numecd.2022.01.014.
23. Stanton AM, Vaduganathan M, Chang LS, et al. Asymptomatic diabetic cardiomyopathy: An underrecognized entity in type 2 diabetes. Curr Diabetes Rep. 2021;21(10):41. DOI:10.1007/s11892-021-01407-2.
24. Seferovic PM, Paulus WJ. Clinical diabetic cardiomyopathy: A two-faced disease with restrictive and dilated phenotypes. Eur Heart J. 2015;36(27):1718-27, 1727a-1727c. DOI:10.1093/eurheartj/ehv134.
25. Liu X, Yang ZG, Gao Y, et al. Left ventricular subclinical myocardial dysfunction in uncomplicated type 2 diabetes mellitus is associated with impaired myocardial perfusion: a contrast-enhanced cardiovascular magnetic resonance study. Cardiovasc Diabetol. 2018;17(1):139. DOI:10.1186/s12933-018-0782-0.
26. Shivu GN, Phan TT, Abozguia K, et al. Relationship between coronary microvascular dysfunction and cardiac energetics impairment in type 1 diabetes mellitus. Circulation. 2010;121(10):1209-15. DOI:10.1161/CIRCULATIONAHA.109.873273.
27. Ledwidge MT, O’Connell E, Gallagher J, et al. Cost-effectiveness of natriuretic peptide-based screening and collaborative care: a report from the STOP-HF (St Vincent’s Screening TO Prevent Heart Failure) study. Eur J Heart Fail. 2015;17(7):672-9. DOI:10.1002/ejhf.286.
28. Ihm SH, Youn HJ, Shin DI, et al. Serum carboxy-terminal propeptide of type I procollagen (Pip) is a marker of diastolic dysfunction in patients with early type 2 diabetes mellitus. Int J Cardiol. 2007;122(3):e36-e8. DOI:10.1016/j.ijcard.2007.07.057.
29. Li Q, Li P, Su J, et al. LncRNA NKILAwas upregulated in diabetic cardiomyopathy with early prediction values. Exp Ther Med. 2019;18(2):1221-5. DOI:10.3892/etm.2019.7671.
30. Галявич А.С., Терещенко С.Н., Ускач Т.М. и др. Хроническая сердечная недостаточность. Клинические рекомендации 2024. Российский кардиологический журнал. 2024;29(11):6162. DOI:10.15829/1560-4071-2024-6162. EDN: WKIDLJ
31. Руяткина Л.А., Руяткин Д.С. Многоплановые эффекты метформина у пациентов с сахарным диабетом 2 типа. Сахарный диабет. 2017;20(3):210-9. DOI:10.14341/DM2003458-64.
32. Eurich DT, Weir DL, Majumdar SR, et al. Comparative safety and effectiveness of metformin in patients with diabetes mellitus and heart failure: systematic review of observational studies involving 34,000 patients. Circ Heart Fail. 2013;6(3):395-402. DOI:10.1161/CIRCHEARTFAILURE.112.000162.
33. Morris A. Diabetes: A new hope for insulin-sensitizing drugs. Nat Rev Endocrinol. 2017;13(12):687. DOI:10.1038/nrendo.2017.150.
34. Мамедов М.Н., Марданов Б.У., Дудинская Е. Н. Сердечная недостаточность у больных сахарным диабетом: диагностика, лечение, профилактика. М.: Фонд «Кардиопрогресс», 2015.
35. Ussher JR, Baggio LL, Campbell JE, et al. Inactivation of the cardiomyocyte glucagonlike peptide-1 receptor (GLP-1R) unmasks cardiomyocyteindependent GLP-1R-mediated cardioprotection. Mol Metab. 2014;3(5):507-17. DOI:10.1016/j.molmet.2014.04.009.
36. Marso SP, Daniels GH, Brown-Frandsen K, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2016;375(4):311-22. DOI:10.1056/NEJMoa1603827.
37. Cowie MR, Fisher M. SGLT2 inhibitors: mechanisms of cardiovascular benefit beyond glycaemic control. Nat Rev Cardiol. 2020;17(12):761-72. DOI:10.1038/s41569-020-0406-8.
38. Sattar N, McLaren J, Kristensen SL, et al. SGLT2 inhibition and cardiovascular events: why did EMPA-REG outcomes surprise and what were the likely mechanisms? Diabetologia. 2016;59(7):1333-9. DOI:10.1007/s00125-016-3987-3.
39. Connelly KA, Mazer CD, Puar P, et al. Empagliflozin and Left Ventricular Remodeling in People Without Diabetes: Primary Results of the EMPA-HEART 2 CardioLink-7 Randomized Clinical Trial. Circulation. 2023;147(4):284-95. DOI:10.1161/CIRCULATIONAHA.122.062769.
40. Sato T, Aizawa Y, Yuasa S, et al. The effect of dapagliflozin treatment on epicardial adipose tissue volume. Cardiovasc Diabetol. 2018;17(1):6. DOI:10.1186/s12933-017-0658-8.
41. Soucek F, Covassin N, Singh P, et al. Effects of atorvastatin (80 mg) therapy on quantity of epicardial adipose tissue in patients undergoing pulmonary vein isolation for atrial fibrillation. Am J Cardiol. 2015;116(9):1443-6. DOI:10.1016/j.amjcard.2015.07.067.
Об авторах
Б. У. МардановРоссия
Марданов Баходир Умаркулович
Москва
М. Н. Мамедов
Россия
Мамедов Мехман Ниязи оглы
Москва
Рецензия
Для цитирования:
Марданов Б.У., Мамедов М.Н. Диабетическая кардиомиопатия: исключительно осложнение или отдельное малоизученное заболевание? Рациональная Фармакотерапия в Кардиологии. 2025;21(3):298-306. https://doi.org/10.20996/1819-6446-2025-3150. EDN: MITYPR
For citation:
Mardanov B.U., Mamedov M.N. Diabetic cardiomyopathy: merely a complication or a distinct understudied disease? Rational Pharmacotherapy in Cardiology. 2025;21(3):298-306. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3150. EDN: MITYPR

















































