Перейти к:
Антитромботическая терапия у пациентов с фибрилляцией предсердий, госпитализированных по поводу инфаркта миокарда в 2016-2023 гг.: анализ выполнения клинических рекомендаций
https://doi.org/10.20996/1819-6446-2025-3169
EDN: YCPPDW
Аннотация
Цель. Проанализировать динамику назначения тройной антитромботической терапии (TATT) при выписке (ТАТТ: оральный антикоагулянт (ОАК) + два антиагреганта) у пациентов с фибрилляцией предсердий (ФП) и острым инфарктом миокарда (ИМ) в 2016-2023 гг., а также соответствие клинической практики клиническим рекомендациям (КР) Европейского общества кардиологов (ЕОК) и Российского кардиологического общества (РКО), одобренным научно-практическим советом Минздрава Российской Федерации .
Материал и методы. Ретроспективно изучены данные 813 пациентов с ФП и острым ИМ, разделенных на четыре группы по времени госпитализации: 2016-2017 гг. (n=104), 2018-2019 гг. (n=256), 2020–2021 гг. (n=239), 2022-2023 гг. (n=214). Проанализированы частота назначения и состав ААТ, а также соответствие ее актуальным КР. В связи с отсутствием КР РКО до 2020 г. проводилась оценка соответствия АТТ КР ЕОК по острому коронарному синдрому без подъема сегмента ST (ОКСбпST) 2015 г. и с подъемом сегмента ST электрокардиограммы 2017 г., а также по ФП 2016 г. После 2020 г. оценивалось соответствие АТТ КР РКО 2020 г. по тем же нозологиям.
Результаты. ОАК и антиагрегант в 2016-2017 гг. были назначены 10,2%, а 2018-2019 гг. — 13,5% включенных пациентов, не подвергнутых чрескожному коронарному вмешательству (ЧКВ), что соответствовало КР ЕОК по ФП 2016 г. Среди пациентов, подвергнутых ЧКВ, ТАТТ была назначена в 2016-2017 гг. в 9,1% случаев, а в 2018-2019 гг. — в 51,0%, что также соответствовало действующим КР ЕОК. Среди пациентов, не подвергнутых ЧКВ, корректная комбинация ОАК и антиагреганта была назначена 17,2% пациентов в 2020-2021 гг. и 27,5% пациентов в 2022-2023 гг. ТАТТ при выписке была назначена 48,7% пациентам с ОКСбпST, подвергнутым ЧКВ, в 2020-2021 гг. и 72,5% — в 2022-2023 гг., что не противоречило КР РКО 2020 г. по ОКСбпST. Сочетание ОАК и антиагреганта пациентам с ИМ с подъемом сегмента ST, подвергнутым ЧКВ, было назначено в 13,3% случаев в 2020-2021 гг. и в 8,6% — в 2022-2023 гг., что соответствовало КР РКО 2020 г. по ИМ с подъемом сегмента ST. В целом применение ОАК выросло с 16,3% в 2016-2017 гг. до 87,9% в 2022-2023 гг.
Заключение. Исследование демонстрирует значительный прогресс в назначении ОАК и ТАТТ, однако сохраняется разрыв между практикой и КР, особенно в составе применяемой комбинированной АТТ терапии при выписке.
Ключевые слова
Для цитирования:
Переверзева К.Г., Якушин С.С., Киндякова Н.А., Мамедов П.Р. Антитромботическая терапия у пациентов с фибрилляцией предсердий, госпитализированных по поводу инфаркта миокарда в 2016-2023 гг.: анализ выполнения клинических рекомендаций. Рациональная Фармакотерапия в Кардиологии. 2025;21(3):217-225. https://doi.org/10.20996/1819-6446-2025-3169. EDN: YCPPDW
For citation:
Pereverzeva K.G., Yakushin S.S., Kindyakova N.A., Mamedov P.R. Antithrombotic therapy in patients with atrial fibrillation hospitalised with myocardial infarction in 2016-2023: timeliness of clinical guideline adherence. Rational Pharmacotherapy in Cardiology. 2025;21(3):217-225. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3169. EDN: YCPPDW
Введение
Фибрилляция предсердий (ФП) — самое распространенное нарушение ритма сердца. Частота её встречаемости в популяции составляет 1-2% в целом и 5-15% у пациентов пожилого и старческого возраста [1]. Инфаркт миокарда (ИМ) является одним из важных патофизиологических состояний, способствующих возникновению ФП [2]. Ежегодная частота встречаемости ФП среди пациентов с ИМ в обсервационных исследованиях колеблется от 0,4% до 2,5% [3]. В то же время ФП может являться патогенетической основой развития ИМ. Она ассоциирована с повышенным риском развития как ИМ с подъемом сегмента ST (ИМпST), так и острого коронарного синдрома без подъема сегмента ST (ОКСбпST) [4]. Смертность, связанная с ФП, после ИМ составляет 1,46% [3]. Пациенты с ИМ и ФП нуждаются в назначении антитромботической терапии (АТТ), сочетающей в себе антиагрегант(-ы) и антикоагулянт [5]. В сравнении с приемом антикоагулянта использование двойной антиагрегантной терапии (ДАТ) более эффективно в отношении профилактики тромбоза стента и ишемии миокарда, но не предупреждает развитие тромбоэмболических осложнений при ФП, риск развития которых снижаются при приеме оральных антикоагулянтов (ОАК) [6].
В настоящее время вопрос об оптимальной АТТ у пациентов с ИМ и ФП окончательно не решен и по-прежнему требует индивидуального подхода.
На момент начала данного исследования в 2016-2017 гг. назначение антикоагулянтной терапии пациентам с ФП и острым коронарным синдромом (ОКС)/ИМ в Российской Федерации (РФ) в связи с отсутствием клинических рекомендаций (КР) Российского кардиологического общества (РКО), одобренных научно-практическим советом Министерства здравоохранения, регламентировалось КР Европейского общества кардиологов (ЕОК); начиная с 2020 г. — КР РКО. Интересным представляется тот факт, что КР 2020 г. по ФП, ОКС/ИМ, посвященные одному и тому же вопросу, — комбинации АТТ у пациентов с ФП и ОКС/ИМ, по ряду позиций были не согласованы. Решение об объеме и длительности АТТ рекомендовалось принимать лечащему врачу, исходя из индивидуальных особенностей пациента и объема оказанной ему медицинской помощи. В связи с этим представляется интересным проанализировать особенности назначения АТТ пациентам с ИМ и ФП в реальной клинической практике.
Цель исследования — проанализировать динамику назначения тройной антитромботической терапии (TATT) при выписке (ТАТТ: оральный антикоагулянт (ОАК) + два антиагреганта) у пациентов с ФП и ИМ в 2016-2023 гг., а также соответствие клинической практики КР ЕОК и РКО.
Материал и методы
Проведено ретроспективное исследование, в которое включались пациенты (n=813), поступившие в 2016-2023 гг. в отделение неотложной кардиологии и имеющие на момент выписки из стационара заключительный диагноз ИМ в сочетании с ФП неклапанной этиологии.
Частота встречаемости ФП при ИМ в 2016-2017 гг. составила 9,1%, в 2018-2019 гг. — 14,7%, в 2020-2021 гг. — 11,6%, в 2022-2023 гг. — 9,5% (p<0,05 для всех сравнений, кроме 2016-2017 гг. и 2022-2023 гг.)
Пациенты были разделены на 4 группы по времени поступления: поступившие в 2016-2017 гг. (1-я, n=104), в 2018-2019 гг. (2-я, n=256), в 2020-2021 гг. (3-я, n=239) и в 2022-2023 гг. (4-я, n=214).
Характеристика пациентов, включенных в исследование представлена в табл.1.
Подвергнуто чрескожному коронарному вмешательству (ЧКВ): в 2016-2017 гг. — 52,9% (n=55), в 2018-2019 гг. — 56,6% (n=145), в 2020-2021 гг. — 57,3% (n=137), в 2022-2023 гг. — 67,8% (n=145); p=0,0001 для сравнений 2016-2017 гг. и 2022-2023 гг., 2018-2019 гг. и 2022-2023 гг., 2020-2021 гг. и 2022-2023 гг. Таким образом, в 2022-2023 гг. статистически значимо большее число пациентов
с ФП и ИМ было подвергнуто ЧКВ.
Источником информации о пациентах и получаемой ими лекарственной терапии служили истории болезни. Участие в данном анализе не требовало каких-либо диагностических/лечебных процедур, выходящих за рамки КР; протокол исследования одобрен локальным этическим комитетом Федерального государственного бюджетного образовательного учреждения высшего образования «Рязанский государственный медицинский университет им. акад. И. П. Павлова» Минздрава России 10 декабря 2018 г., протокол № 5. Отдельная форма информированного согласия пациента на участие в исследование не одобрялась и не подписывалась в связи с его ретроспективным характером. Пациенты подписывали информированное согласие по стандартной для медицинского учреждения форме. Более подробно методология исследования описана в опубликованных ранее работах [7-9].
Статистическая обработка материала проводилась с помощью программы Statistica 11.0 (Stat Soft Inc., США) и пакета MS Excel 2019 (Microsoft, США). Количественные признаки имели распределение, отличное от нормального, и описывались медианой, нижним и верхним квартилями в виде Me (Q1; Q3). Однако для удобства сравнения ряд количественных признаков представлен в виде среднего значения и среднеквадратичного отклонения в виде M (SD). Категориальные данные представлены в виде частот (%). Сравнение двух несвязанных групп по качественному признаку проводилось с помощью таблиц сопряжённости (критерий χ² по Пирсону с поправкой Йетса и точный критерий Фишера), по количественному признаку — с помощью критерия Краскела–Уоллиса. Различия считали значимыми при p <0,05 и в случае множественных сравнений для контроля вероятности ошибки первого рода использовалась поправка Бонферрони (при сравнении 4 групп различия считались значимыми при p <0,008).
Таблица 1. Характеристика включенных пациентов
Параметр | 2016-2017 гг. | 2018-2019 гг. | 2020-2021 гг. | 2022-2023 гг. | p |
1 (n=104) | 2 (n=256) | 3 (n=239) | 4 (n=214) | ||
Возраст, годы, Mе (Q1;Q3) | 70 (61,0; 78,0) | 71 (65,0; 79,3) | 72 (65,0; 80,0) | 71 (68,3; 75,3) | >0,05 |
Доля мужчин, n (%) | 60 (55,6) | 141 (55,8) | 126 (53,1) | 127 (58,9) | >0,05 |
Результаты
При оценке риска тромбоэмболических осложнений по шкале CHA₂DS₂-VASc медиана баллов для пациентов, госпитализированных в 2016-2017 гг., 2018-2019 гг., 2020-2021 гг. и 2022-2023 гг., была одинаковой и составила 5,0 (4,0; 6,0) баллов. Однако полученные средние значения баллов по CHA₂DS₂-VASc статистически значимо различались между пациентами, госпитализированными в 2018-2019 гг. и 2020-2021 гг. (p=0,00004), а также в 2020-2021 гг. и 2022-2023 гг. (p=0,004), и составили: в 2018-2019 гг. — 5,2 (1,5) балла, в 2020-2021 гг. — 4,7 (1,4) балла, в 2022-2023 гг. — 5,1 (1,5) балла. Среднее значение баллов по CHA₂DS₂-VASc в 2016-2017 гг. составило 5,0 (1,7) балла. Из 813 пациентов только один мужчина имел 1 балл по шкале CHA₂DS₂-VASc, т.е. назначение ему антикоагулянтной терапии не являлось обязательным. Таким образом, 99,9% пациентов имели показания для назначения ОАК.
При оценке риска геморрагических осложнений на фоне приёма ОАК по шкале HAS-BLED медиана баллов для пациентов, госпитализированных в 2016-2017 гг., 2018-2019 гг. и 2022-2023 гг., составила 2,0 (2,0; 3,0) балла, а в 2020-2021 гг. — 3,0 (3,0; 3,0) балла. Средние значения баллов по шкале HAS-BLED: в 2016-2017 гг. — 2,3 (1,1) балла, в 2018-2019 гг. — 2,1 (0,9) балла, в 2020-2021 гг. — 3,1 (0,8) балла, в 2022-2023 гг. — 3,0 (0,8) балла. 55,6% (n=772) пациентов при оценке по шкале HAS-BLED в 2016-2023 гг. набрали ≥3 баллов.
При этом по числу баллов по шкале HAS-BLED между пациентами, госпитализированными в 2020-2021 гг., была статистически значимая разница по сравнению с пациентами, госпитализированными в 2016-2017 гг. (p <0,000001) и 2018-2019 гг. (p <0,01). Аналогичные различия выявлены между пациентами, госпитализированными в 2016-2017 гг. и 2022-2023 гг. (p <0,0001), 2018-2019 гг. и 2022-2023 гг. (p <0,0001).
В табл. 2 представлена динамика частоты встречаемости отдельных факторов риска шкалы HAS-BLED в 2016-2023 гг.
Выявлено увеличение числа пациентов с кровотечениями/анемиями в 2020-2021 гг. в сравнении с остальными годами (см. табл. 2).
Независимо от года исследования из кардиологического диспансера выписываются пациенты с ФП и ИМ с высокими рисками геморрагических и ишемических осложнений. Однако подход к назначению АТТ за 2016-2023 гг. значительно изменился, что отражено в табл. 3. При этом частота назначения ДАТ с 2016-2017 гг. по 2020-2021 гг. снижалась (p для всех сравнений <0,001). В 2020-2021 гг.
и 2022-2023 гг. частота назначения ДАТ составила 15,9% и 8,4%, соответственно, при этом различия не достигли статистической значимости (в случае множественных сравнений значение p-value составило 0,02). Частота назначения ОАК в целом и в составе ТАТТ в 2016-2023 гг. увеличилась (p для всех сравнений <0,001). Разница в частоте назначения монотерапии антиагрегантом или ОАК, назначения комбинации ОАК+антиагрегант или отказа от назначения АТТ не достигла статистической значимости.
В 2016-2017 гг. среди 55 пациентов, подвергнутых ЧКВ, 9,1% (n=5) получали ТАТТ; 7,3% (n=4) — ОАК в сочетании с одним антиагрегантом; 83,6% (n=46) — ДАТ.
Среди 49 пациентов, не подвергнутых ЧКВ, 4,1% (n=2) получали ТАТТ; 10,2% (n=5) — ОАК в сочетании с одним антиагрегантом; 69,4% (n=34) — ДАТ; 8,2% (n=4) и 2,0% (n=1) пациентов получали монотерапию антиагрегантом и ОАК, соответственно, а 6,1% (n=3) АТТ назначена не была.
В 2018-2019 гг. среди 145 пациентов, подвергнутых ЧКВ, ТАТТ получали 51,0% (n=74), ДАТ — 42,1% (n=61), сочетание ОАК и антиагреганта — 6,9% (n=10). Среди 111 пациентов, не подвергнутых ЧКВ, ТАТТ получали 36,9% (n=41), ДАТ — 32,4% (n=36), сочетание ОАК и антиагреганта — 13,5% (n=15); 17,1% (n=19) пациентов получали монотерапию антиагрегантом.
В 2020-2021 гг. среди пациентов, подвергнутых ЧКВ (n=137), ТАТТ получали 59,1% (n=81); ДАТ — 21,2% (n=29); сочетание ОАК и антиагреганта — 12,4% (n=17); монотерапию антиагрегантом — 6,6% (n=9); и один пациент не получал АТТ.
Среди пациентов, не подвергнутых ЧКВ (n=99), ТАТТ получали 62,6% (n=62); ДАТ — 9,1% (n=9); сочетание ОАК и антиагреганта — 17,2% (n=17); монотерапию антиагрегантом — 9,1% (n=9).
В 2022-2023 гг. среди 145 пациентов, подвергнутых ЧКВ, ТАТТ получали 77,9% (n=113); ДАТ — 10,3% (n=15); сочетание ОАК и антиагреганта — 7,6% (n=11); монотерапию антиагрегантом — 4,1% (n=6). Среди 69 пациентов, не подвергнутых ЧКВ, ТАТТ получали 59,4% (n=41); ДАТ — 10,1% (n=7); сочетание ОАК и антиагреганта — 27,5% (n=19); монотерапию антиагрегантом — 2,9% (n=2).
Назначение ДАТ с 2016 по 2023 гг. статистически значимо снизилось, а применение ОАК значительно возросло, как в целом, так и в составе ТАТТ (табл. 3). Частота назначения ОАК пациентам, не подвергнутым ЧКВ в 2016-2023 гг., представлена в табл. 4.
Частота назначения ОАК пациентам, подвергнутым ЧКВ в 2016-2023 гг., представлена на рис. 1-3 и в табл. 5.
Структура назначаемой антикоагулянтной терапии за 8 лет наблюдения приведена в табл. 6. Частота назначения прямых ОАК с 2016 по 2023 гг. статистически значимо выросла почти в три раза, а частота назначения варфарина снизилась более чем в 11 раз.
Таблица 2. Частота факторов риска, включённых в шкалу HAS-BLED, у пациентов с ИМ и ФП в 2016-2023 гг.
Фактор риска | 2016-2017 гг. | 2018-2019 гг. | 2020-2021 гг. | 2022-2023 гг. | p |
1 (n=104) | 2 (n=256) | 3 (n=239) | 4 (n=214) | ||
Кровотечение/анемия, n (%) | 2 (1,9) | 30 (11,7) | 57 (23,8) | 30 (14,0) | p<0,05 |
Нарушение функции почек, n (%) | 7 (6,7) | 11 (4,3) | 7 (2,9) | 12 (5,6) | p>0,05 |
Нарушение функции печени, n (%) | 9 (8,5) | 8 (3,1) | 17 (7,1) | 9 (4,2) | p≥0,05 |
Острое нарушение мозгового кровообращения, n (%) | 17 (16,3) | 37 (14,5) | 24 (10,0) | 30 (14,0) | p>0,05 |
Прием лекарственных средств, повышающих риск кровотечений (антиагрегантов) n (%) | 101 (97,7) | 256 (100,0) | 239 (100,0) | 214 (100,0) | p<0,05 |
Злоупотребление алкоголем, n (%) | 0 | 0 | 0 | 0 | — |
Значения p-value для фактора риска «Кровотечение/анемия»: р1-2=0,003*; р1-3=0,00001*; р1-4=0,0005*; р2-3=0,0004*; ИМ — инфаркт миокарда, ФП — фибрилляция предсердий | |||||
Таблица 3. Профиль назначаемой антитромботической терапии при ИМ и ФП в 2016-2023 гг.
Назначаемая терапия | 2016-2017 гг. | 2018-2019 гг. | 2020-2021 гг. | 2022-2023 гг. |
1 (n=104) | 2 (n=256) | 3 (n=239) | 4 (n=214) | |
Двойная антиагрегантная терапия, n (%) | 80 (76,9) | 97 (37,9) | 38 (15,9) | 18 (8,4) |
Оральные антикоагулянты, n (%) | 17 (16,3) | 140 (54,7) | 177 (74,1) | 188 (87,9) |
Тройная антитромботическая терапия, n (%) | 7 (6,7) | 115 (44,9) | 143 (59,8) | 157 (73,4) |
Оральный антикоагулянт + антиагрегант, n (%) | 9 (8,7) | 25 (9,8) | 34 (14,2) | 30 (14,0) |
Антиагрегант (монотерапия), n (%) | 4 (3,8) | 19 (7,4) | 18 (7,5) | 8 (3,7) |
Монотерапия оральным антикоагулянтом, n (%) | 1 (1,0) | 0 (0) | 0 (0) | 0 (0) |
Антитромботическая терапия не назначена, n (%) | 3 (2,9) | 0 (0) | 4 (1,7) | 0 (0) |
Данные включают всех пациентов (с проведением ЧКВ и без) ИМ — инфаркт миокарда, ФП — фибрилляция предсердий | ||||
Таблица 4. Антитромботическая терапия, назначаемая в 2016-2023 гг. пациентам с ИМ и ФП, не подвергнутым ЧКВ
Назначаемая терапия | 2016-2017 гг. | 2018-2019 гг. | 2020-2021 гг. | 2022-2023 гг. |
1 (n=49) | 2 (n=111) | 3 (n=99) | 4 (n=69) | |
Двойная антиагрегантная терапия, n (%) | 34 (69,4) | 36 (32,4) | 9 (9,1) | 7 (10,1) |
Оральные антикоагулянты, n (%) | 8 (16,3) | 56 (50,5) | 79 (79,8) | 60 (87,0) |
Тройная антитромботическая терапия, n (%) | 2 (4,1) | 41 (36,9) | 62 (62,6) | 41 (59,4) |
Оральный антикоагулянт + антиагрегант, n (%) | 5 (10,2) | 15 (13,5) | 17 (17,2) | 19 (27,5) |
Антиагрегант (монотерапия), n (%) | 4 (8,2) | 19 (17,1) | 9 (9,1) | 2 (2,9) |
Антитромботическая терапия не назначена, n (%) | 3 (6,1) | — | — | — |
Монотерапия оральным антикоагулянтом, n (%) | 1 (2,0) | — | — | — |
ИМ — инфаркт миокарда, ФП — фибрилляция предсердий, ЧКВ — чрескожное коронарное вмешательство | ||||

Рисунок 1. Антитромботическая терапия, назначаемая в 2016-2023 гг. пациентам с ИМ и ФП, подвергнутым ЧКВ.
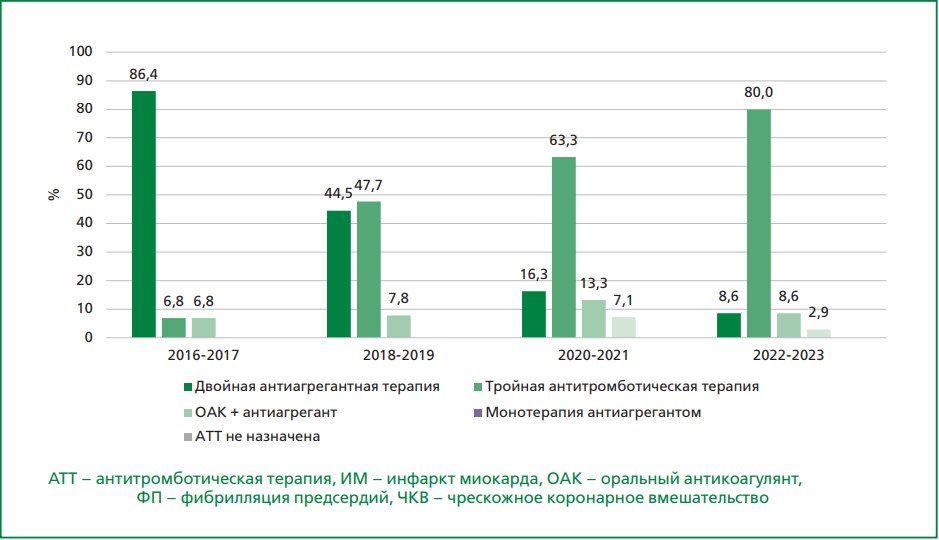
Рисунок 2. Антитромботическая терапия, назначаемая в 2016-2023 гг. пациентам с ИМпST и ФП, подвергнутым ЧКВ.
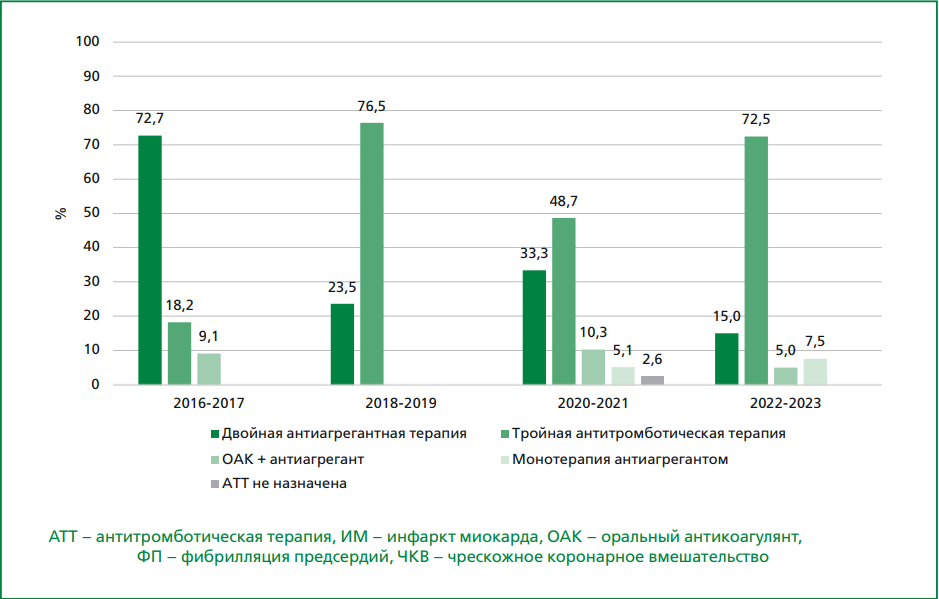
Рисунок 3. Антитромботическая терапия, назначаемая в 2016-2023 гг. пациентам с ИМбпST и ФП, подвергнутым ЧКВ.
Таблица 5. Антитромботическая терапия, назначаемая в 2016-2023 гг. пациентам с ИМ и ФП, подвергнутым ЧКВ
Назначаемая терапия | 2016-2017 гг. | 2018-2019 гг. | 2020-2021 гг. | 2022-2023 гг. |
n=55 | n=145 | n=137 | n=145 | |
Двойная антиагрегантная терапия, n (%) | 46 (83,6) | 61 (42,1) | 29 (21,2) | 15 (10,3) |
Оральные антикоагулянты, n (%) | 9 (16,4) | 84 (57,9) | 98 (71,5) | 124 (85,5) |
Тройная антитромботическая терапия, n (%) | 5 (9,1) | 74 (51,0) | 81 (59,1) | 113 (77,9) |
Оральный антикоагулянт + антиагрегант, n (%) | 4 (7,3) | 10 (6,9) | 17 (12,4) | 11 (7,6) |
Антиагрегант (монотерапия), n (%) | — | — | 9 (6,6) | 6 (4,1) |
Антитромботическая терапия не назначена, n (%) | — | — | 1 (0,7) | — |
Монотерапия оральным антикоагулянтом, n (%) | — | — | — | — |
ИМ — инфаркт миокарда, ФП — фибрилляция предсердий, ЧКВ — чрескожное коронарное вмешательство | ||||
Таблица 6. Частота назначения оральных антикоагулянтов в 2016-2023 гг.
Назначаемая терапия | 2016-2017 гг. | 2018-2019 гг. | 2020-2021 гг. | 2022-2023 гг. | p |
1 (n=17) | 2 (n=140) | 3 (n=178) | 4 (n=188) | 1-4 | |
Прямые оральные антикоагулянты, n (%) | 6 (35,3) | 89 (63,6) | 167 (93,8) | 177 (94,1) | <0,0001 |
Варфарин, n (%) | 11 (64,7) | 51 (36,4) | 11 (6,2) | 11 (5,9) |
Обсуждение
На момент начала исследования в 2016-2017 гг. назначение антикоагулянтной терапии пациентам с ФП и ОКС/ИМ в РФ в связи с отсутствием КР РКО регламентировалось КР ЕОК по ФП 2016 г. [10], в которых было рекомендовано при ФП в случае ОКС без имплантации стента использовать антикоагулянт + антиагрегант на период до 12 мес. (при повышенном риске инсульта). Такая тактика ведения была осуществлена у 10,2% включенных пациентов, не подвергнутых ЧКВ, в 2016-2017 гг. Назначение ОАК этой группе пациентов в 2018-2019 гг. регламентировалось теми же КР, и в этот период правильная тактика назначения ОАК была реализована ненамного чаще (по сравнению с 2016-2017 гг. на 3,3%) — у 13,5% пациентов.
Примечательно, что в КР ЕОК по ведению пациентов с ОКС без подъема сегмента ST (ОКСбпST) 2015 г. [11] и с острым ИМ с подъемом сегмента ST (ИМпST) 2017 г. указаний по назначению ОАК пациентам с ФП, не подвергнутых ЧКВ, нет [12].
Начиная с 2020 г., были утверждены научно-практическим советом Минздрава России и стали доступны КР РКО. Однако в КР «Фибрилляция и трепетание предсердий» 2020 г. нет указаний о назначении ОАК пациентам с ФП и ОКС без ЧКВ [13].
В КР РКО от 2020 г. «Острый ИМпST электрокардиограммы» [14] указано, что «У пациентов с ИМпST, нуждающихся в длительном использовании пероральных антикоагулянтов, которым не выполнялось коронарное стентирование, рекомендуется сочетание одного антитромбоцитарного препарата с пероральным антикоагулянтом (двойная антитромботическая терапия)». «Если при ОИМпST ЧКВ не проводилось, ТАТТ не рекомендуется, однако она может быть рассмотрена в индивидуальном порядке у пациентов с низким риском кровотечений и высоким риском коронарных осложнений, в остальных случаях на 12 месяцев назначается двойная АТТ» [14].
В КР РКО «ОКСбпST электрокардиограммы» 2020 г. [15] также указано, что «У пациентов с ОКСбпST, нуждающихся в длительном использовании антикоагулянтов, которым не выполнялось стентирование коронарных артерий, рекомендуется пероральный прием антикоагулянта в сочетании с одним антиагрегантом для снижения риска кровотечений». Такой подход был реализован у 17,2% включенных пациентов в 2020-2021 гг. и 27,5% в 2022-2023 гг.
Что касается пациентов, подвергнутых ЧКВ, то в КР ЕОК по ведению ОКСбпST 2015 г. [11], прямых указаний по назначению ОАК пациентам с ОКСбпST и ФП после ЧКВ нет. Однако в КР ЕОК по ФП 2016 г. пациентам после ОКС и ЧКВ была рекомендована ТАТТ в течение 1-6 мес. (при повышенном риске инсульта) [10] и в КР ЕОК по ведению пациентов с острым ИМпST 2017 г. было указано, что ОАК в сочетании с ацетилсалициловой кислотой и клопидогрелом должны применяться в течение 1-6 месяцев. Минимальная длительность ТАТТ (1 мес.) была возможна при высоком риске кровотечений, HAS-BLED ≥3 [12]. ТАТТ в представленном исследовании была назначена в 2016-2017 гг. 9,1% пациентов, а в 2018-2019 гг. — 51,0%. Помимо действующих КР ЕОК, в 2018 г. был опубликован и вступил в силу коллегиальный европейский документ [16], в котором было указано, что длительность ТАТТ у пациентов с очень высоким риском кровотечения может быть ограничена периодом госпитализации, а назначение двойной АТТ (комбинация полной дозы прямого ОАК и клопидогрела) возможно сразу после выписки пациента из стационара.
В КР РКО «Фибрилляция и трепетание предсердий» 2020 г. [13] пациентам после ОКС при высоком риске инсульта после ЧКВ со стентированием рекомендовано назначение ТАТТ на срок 1-6 мес. Если после ОКС и ЧКВ риск геморрагических осложнений превышает риск ишемических осложнений, ТАТТ используется в течение 1 мес.
В отличие от КР по ФП (2020 г.) в КР РКО от 2020 г. «Острый ИМпST электрокардиограммы» [14] после ЧКВ для уменьшения риска геморрагических осложнений длительность применения ТАТТ рекомендуется ограничить несколькими днями — 1-7 дней, после чего до 12 мес. применять двойную АТТ (ОАК и антиагрегант), после чего — монотерапию ОАК. А в КР РКО от 2020 г. «ОКСбпST электрокардиограммы» [15] указано, что «При необходимости в длительном использовании антикоагулянтов у пациентов с ОКСбпST, подвергнутых стентированию коронарных артерий, рекомендуется сочетание перорального приема антикоагулянта с ацетилсалициловой кислотой и клопидогрелом (ТАТТ) длительностью от 1 до 3 месяцев с переходом на сочетание перорального приема антикоагулянта с клопидогрелом или ацетилсалициловой кислотой (двойная АТТ) вплоть до 12-го месяца и последующей отменой антитромбоцитарных препаратов для снижения риска коронарных и тромбоэмболических осложнений».
В связи с этим у большинства пациентов, выписанных в 2020-2023 гг., с ИМпST к моменту выписки ТАТТ должна быть завершена; вместе с тем в проведенном исследовании на момент выписки в 2020-2021 гг. ТАТТ получали 63,3% пациентов, а в 2022-2023 гг. — 80,0% пациентов с ИМпST. Таким образом, корректная терапия ОАК и одним антиагрегантом применялась у 13,3% и 8,6% пациентов с ИМпST в 2020-2021 гг. и 2022-2023 гг., соответственно.
При ИМбпST в 2020-2021 гг. ТАТТ была назначена в 48,7% случаев, а терапия ОАК и одним антиагрегантом — в 10,3%; в 2022-2023 гг. ТАТТ и терапию ОАК и одним антиагрегантом получали 72,5% и 5,0% пациентов с ИМбпST, соответственно. При этом назначение ТАТТ в этой группе пациентов представляется обоснованным, так как и в КР РКО по ФП [13], и в КР РКО по ОКСбпST [15] в этой группе пациентов указана длительность ТАТТ, как минимум, на протяжении 1 мес. после ИМ, т.е. ТАТТ должна быть продолжена при выписке в более ранние сроки.
Полученные нами данные, как и результаты других работ, «позволяют предполагать наличие системных ошибок в усвоении и интерпретации врачами положений клинических рекомендаций, касающихся практического применения ОАК» [17]. Так, в работе К.В. Лобастова и соавт. было показано, что «соответствие длительности антикоагулянтной терапии в условиях реальной клинической практики международным КР варьирует в пределах 4-50% и в среднем не превышает 30%» (при венозной тромбоэмболии) [18].
Одной из возможных причин ошибок в назначении ОАК является несогласованность КР по ряду положений назначения ОАК пациентам с сочетанием ФП и ИМ, которая в настоящее время в КР РКО 2024 г. по ИМпST/ОКСбпST [19-20] устранена (КР РКО по ФП к моменту написания статьи не обновлены). Другими возможными причинами, связанными непосредственно с КР, могут являться: ограниченная применимость в реальных ситуациях; недостаточная ясность или специфичность КР; неприменимость к некоторым конкретным пациентам, например, с сопутствующими заболеваниями; частая смена КР; ограниченное доверие к КР и другие [21]. Более того, сложности внедрения КР могут быть обусловлены не только факторами, связанными с КР, но и с политическими, социальными, культурными, средовыми и многими другими факторами [21], которые требуют изучения непосредственно среди врачей РФ и разработки мер их устранения.
Ограничения исследования
Ретроспективный дизайн — данные собраны из медицинской документации, что могло привести к пропуску информации; авторами не анализировались социально-экономические факторы, приверженность лечению и доступность препаратов, которые могли повлиять на назначения, так же не были учтены индивидуальные клинические решения, которые могли обосновать отклонения от КР (например, противопоказания, предпочтения пациента).
Заключение
За 2016-2023 гг. назначение ОАК возросло с 16,3% до 87,9%, а использование ТАТТ — с 6,7% до 73,4%. Однако сохраняется значительный разрыв между КР и практикой. Проведенное исследование еще раз подтвердило имеющиеся сложности следования актуальным КР в реальной клинической практике и обосновало необходимость изучения существующих барьеров и разработки эффективных стратегий внедрения КР в работу врачей.
Список литературы
1. Stewart S, Hart CL, Hole DJ, McMurray JJ. Population prevalence, incidence, and predictors of atrial fibrillation in the Renfrew/Paisley study. Heart 2001;86(5):516- 21. DOI:10.1136/heart.86.5.516.
2. Hindricks G, Potpara T, Dagres N, et al.; ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2020;42(5):373-498. DOI:10.1093/eurheartj/ehaa612. Erratum in: Eur Heart J. 2021;42(5):507. DOI:10.1093/eurheartj/ehaa798. Erratum in: Eur Heart J. 2021;42(5):546-547. DOI:10.1093/eurheartj/ehaa945. Erratum in: Eur Heart J. 2021;42(40):4194. DOI:10.1093/eurheartj/ehab648.
3. Violi F, Soliman EZ, Pignatelli P, et al. Atrial Fibrillation and Myocardial Infarction: A Systematic Review and Appraisal of Pathophysiologic Mechanisms. J Am Heart Assoc. 2016;5(5):e003347. DOI:10.1161/JAHA.116.003347.
4. Шишкина Е.А., Хлынова О.В., Лебедева Ю.И. и др. Фибрилляция предсердий и инфаркт миокарда: клинико-патогенетические взаимосвязи и влияние на прогноз. Доктор.Ру. 2023;22(8):23-8. DOI:10.31550/1727-2378-2023-22-8-23-28.
5. Паршикова Е.Н., Филиппов Е.В. Смертность от всех причин у пациентов с инфарктом миокарда с подъемом сегмента ST в зависимости от типа реперфузионной терапии. Российский медикобиологический вестник имени академика И.П. Павлова. 2020;28(4):479-87. DOI:10.23888/PAVLOVJ2020284479-487.
6. ACTIVE Writing Group of the ACTIVE Investigators; Connolly SJ, Pogue J, Hart RG, et al. Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial Fibrillation Clopidogrel Trial With Irbesartan for Prevention of Vascular Events (ACTIVE W): a randomized controlled trial. Lancet. 2006;367(9526):1903- 12. DOI:10.1016/S0140-6736(06)68845-4.
7. Переверзева К.Г., Якушин С.С., Припадчева А.Э., Агальцова Н.П. Антитромботическая терапия у пациентов с фибрилляцией предсердий после инфаркта миокарда: клинические рекомендации и реальная практика. Рациональная Фармакотерапия в Кардиологии. 2018;14(6):858-63. DOI:10.20996/1819-6446-2018-14-6-858-863.
8. Переверзева К.Г., Якушин С.С., Ежова А.В. и др. Динамика назначения антитромботической терапии у пациентов с фибрилляцией предсердий и инфарктом миокарда в 2016-2019 гг. Российский кардиологический журнал. 2020;25(7):3908. DOI:10.15829/1560-4071-2020-3908.
9. Коршикова А.А., Переверзева К.Г., Якушин С.С. Динамика назначения антитромботической терапии пациентам с фибрилляцией предсердий, госпитализированным по поводу инфаркта миокарда в 2016-2021 гг. Российский медико-биологический вестник имени академика И.П. Павлова. 2023;31(3):405-14. DOI:10.17816/PAVLOVJ109417.
10. Kirchhof P., Benussi S., Kotecha D. и др. Рекомендации ESC по лечению пациентов с фибрилляцией предсердий, разработанные совместно с EACTS. Российский кардиологический журнал. 2017;(7):7-86. DOI:10.15829/1560-4071-2017-7-7-86.
11. Рекомендации ESC по ведению пациентов с острым коронарным синдромом без стойкого подъема сегмента ST 2015. Российский кардиологический журнал. 2016;(3):9-63. DOI:10.15829/1560-4071-2016-3-9-63.
12. Рекомендации ESC по ведению пациентов с острым инфарктом миокарда с подъемом сегмента ST 2017. Российский кардиологический журнал. 2018;(5):103-58. DOI:10.15829/1560-4071-2018-5-103-158.
13. Аракелян М.Г., Бокерия Л.А., Васильева Е.Ю. и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4594. DOI:10.15829/1560-4071-2021-4594.
14. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4103. DOI:10.15829/1560-4071-2020-4103.
15. Барбараш О.Л., Дупляков Д.В., Затейщиков Д.А. и др. Острый коронарный синдром без подъема сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(4):4449. DOI:10.15829/1560-4071-2021-4449.
16. Lip GYH, Collet JP, Haude M, et al.; ESC Scientific Document Group, et al. 2018 Joint European consensus document on the management of antithrombotic therapy in atrial fibrillation patients presenting with acute coronary syndrome and/or undergoing percutaneous cardiovascular interventions: a joint consensus document of the European Heart Rhythm Association (EHRA), European Society of Cardiology Working Group on Thrombosis, European Association of Percutaneous Cardiovascular Interventions (EAPCI), and European Association of Acute Cardiac Care (ACCA) endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS), Latin America Heart Rhythm Society (LAHRS), and Cardiac Arrhythmia Society of Southern Africa (CASSA). Europace. 2019;21(2):192-3. DOI:10.1093/europace/euy174.
17. Перепеч Н.Б., Михайлова И.Е., Трегубов А.В. Приверженность врачей рекомендациям по применению пероральных антикоагулянтов. Рациональная Фармакотерапия в Кардиологии. 2020;16(5):706-12. DOI:10.20996/1819-6446-2020-10.
18. Лобастов К.В., Навасардян А.Р., Счастливцев И.В. Вторичная профилактика венозных тромбоэмболических осложнений в реальной клинической практике по данным анкетировани я врачей. Рациональная Фармакотерапия в Кардиологии. 2021;17(3):376-85. DOI:10.20996/1819-6446-2021-06-01.
19. Аверков О.В., Арутюнян Г.К., Дупляков Д.В. и др. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2024. Российский кардиологический журнал. 2025;30(3):6306. DOI:10.15829/1560-4071-2025-6306.
20. Аверков О.B., Арутюнян Г.К., Дупляков Д.В. и др. Острый коронарный синдром без подъема сегмента ST электрокардиограммы. Клинические рекомендации 2024. Российский кардиологический журнал. 2025;30(5):6319. DOI: 10.15829/1560-4071-2025-6319.
21. Wang T, Tan JB, Liu XL, Zhao I. Barriers and enablers to implementing clinical practice guidelines in primary care: an overview of systematic reviews. BMJ Open. 2023;13(1):e062158. DOI:10.1136/bmjopen-2022-062158.
Об авторах
К. Г. ПереверзеваРоссия
Переверзева Кристина Геннадьевна
Рязань
С. С. Якушин
Россия
Якушин Сергей Степанович
Рязань
Н. А. Киндякова
Россия
Киндякова Наталия Александровна
Рязань
П. Р. Мамедов
Россия
Мамедов Полад Руфи оглы
Рязань
Дополнительные файлы
Рецензия
Для цитирования:
Переверзева К.Г., Якушин С.С., Киндякова Н.А., Мамедов П.Р. Антитромботическая терапия у пациентов с фибрилляцией предсердий, госпитализированных по поводу инфаркта миокарда в 2016-2023 гг.: анализ выполнения клинических рекомендаций. Рациональная Фармакотерапия в Кардиологии. 2025;21(3):217-225. https://doi.org/10.20996/1819-6446-2025-3169. EDN: YCPPDW
For citation:
Pereverzeva K.G., Yakushin S.S., Kindyakova N.A., Mamedov P.R. Antithrombotic therapy in patients with atrial fibrillation hospitalised with myocardial infarction in 2016-2023: timeliness of clinical guideline adherence. Rational Pharmacotherapy in Cardiology. 2025;21(3):217-225. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3169. EDN: YCPPDW

















































