Перейти к:
Прогностические факторы рестеноза стента у пациентов с ишемической болезнью сердца, перенёсших чрескожное коронарное вмешательство
https://doi.org/10.20996/1819-6446-2025-3177
EDN: FNKZUC
Аннотация
Цель. Изучить взаимосвязь между уровнями липопротеина(а) (Лп(а)), фактора роста эндотелия сосудов (VEGF), трансформирующего фактора роста β (TGF-β) в плазме крови, и возникновением рестеноза стента после чрескожного коронарного вмешательства у пациентов с ишемической болезнью сердца (ИБС), а также достижением целевого уровня холестерина липопротеинов низкой плотности (ХС ЛНП) на фоне гиполипидемической терапии.
Материал и методы. В проспективное наблюдение включены 92 пациента (средний возраст составил 64,0 года, 79,5% мужчины, 20,5% женщины) с диагнозом острого коронарного синдрома (ОКС), которым установили стенты в клинически значимую или инфаркт-связанную коронарную артерию. Одновременно визуально в процессе селективной коронарографии определяли кровоток в остальных коронарных артериях. При гемодинамически значимом стенозе коронарной артерии, не связанной с ОКС, на 70-90% больного приглашали на консультацию к кардиологу через 1 мес. с целью решения вопроса о реваскуляризации миокарда через нагрузочное тестирование с учётом клинического статуса пациента (жалоб). В случае необходимости повторной селективной коронарографии с лечебной целью через 1-2 мес. у пациентов визуализировали формирование неоинтимы, уточняли степень рестеноза внутри стента, ранее установленного в инфаркт-связанной артерии в сочетании с определением в плазме крови Лп(а), VEGF, TGF-β. Оценивали достижение целевого уровня ХС ЛНП на фоне гиполипидемической терапии. Пациенты были разделены на 2 группы: с выявленным рестенозом или неоинтимой (n=49) и без рестеноза (n=43). В группах сравнивали полученные клинико-лабораторные и ангиографические данные.
Результаты. Развитие рестеноза связано с продолжительным течением ИБС на протяжении 6,0 (4,0; 11,0) мес. (p<0,001), стабильной ИБС в 42,86% случаев (p=0,01), хронической болезнью почек 3А — 32,65% (p=0,02) и применением стента BMS (bare-metal stent) — 79,59% (n=39) (p<0,001), уровнем Лп(а) >30 мг/дл — 36,73% (p=0,01). При исследовании сочетаний двух комбинаций TGF-β + Лп(а) и Лп(а) + VEGF выявлено, что нахождение в границах нормативных значений обоих указанных показателей одновременно является протективным фактором относительно развития рестеноза — отношение шансов=0,2 [95% доверительный интервал 0,07-0,56] и отношение шансов=0,33 [95% доверительный интервал 0,14-0,82], соответственно.
Заключение. У пациентов с ИБС через 1-2 мес. после чрескожного коронарного вмешательства на фоне ОКС развитие рестеноза ассоциировано с продолжительным течением ИБС, хронической болезнью почек 3А и типом стента BMS, повышенным уровнем Лп(а) >30 мг/дл, независимо от достижения целевого уровня ХС ЛПН <1,4 ммоль/л. Увеличение значений исходного Лп(а) в комбинации с показателями VEGF и TGF-β в плазме крови указывает на высокий риск рестеноза стента, что может быть новыми биомаркерами для прогнозирования прогрессирования ИБС. Эти результаты подтверждают необходимость разработки практических рекомендаций по динамическому наблюдению данной группы пациентов.
Ключевые слова
Для цитирования:
Мешкова М.А., Стародубцева И.А., Пашкова А.А. Прогностические факторы рестеноза стента у пациентов с ишемической болезнью сердца, перенёсших чрескожное коронарное вмешательство. Рациональная Фармакотерапия в Кардиологии. 2025;21(2):132-142. https://doi.org/10.20996/1819-6446-2025-3177. EDN: FNKZUC
For citation:
Meshkova M.А., Starodubtseva I.A., Pashkova A.A. Prognostic factors for stent restenosis in patients with coronary artery disease undergoing percutaneous coronary intervention. Rational Pharmacotherapy in Cardiology. 2025;21(2):132-142. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3177. EDN: FNKZUC
Введение
Контроль и оперативное выявление заболеваний системы кровообращения имеют решающее значение для предотвращения острых сердечно-сосудистых осложнений [1]. Сокращение числа умерших возможно только за счёт повышения поиска предикторов обострения среди пациентов с болезнями системы кровообращения в рамках вторичной профилактики при эффективном диспансерном наблюдении. Ангиографические исследования в больших группах пациентов с ишемической болезнь сердца (ИБС) показывают, что частота возникновения ангиографического ишемического синдрома (рестеноза внутри стента) составляет 10%, даже при использовании стентов с лекарственным покрытием нового поколения [2]. В большинстве случаев рестеноз стента рассматривают как независимый фактор риска летального исхода наряду с другими важными клиническими факторами: возрастом, полом, сахарным диабетом (СД), курением, аортокоронарным шунтированием и снижением фракции выброса левого желудочка [3]. Так, при экстренном чрескожном коронарном вмешательстве (ЧКВ) в исследовании Д. В. Шамеса факторами риска рестеноза являются: тромбоцитарно-лимфоцитарное соотношение, уровень общего холестерина, степень тяжести коронарного атеросклероза; после планового стентирования — ширина распределения эритроцитов по объёму, уровень фибриногена, степень тяжести коронарного атеросклероза, количество одновременно имплантированных стентов, СД, дислипидемия [4]. С помощью множественного логистического регрессионного анализа обнаружено, что курение, СД, длина стента, предпроцедурное нейтрофильно-лимфоцитарное соотношение и С-реактивный белок являются независимыми предикторами рестеноза [5][6]. Но малоизученным для прогнозирования риска рестенозов остаётся одновременное сочетание нескольких клинических факторов и биохимических маркеров: уровней липопротеина(а) (Лп(а)), факторов роста эндотелия сосудов (VEGF), трансформирующего фактор роста β (TGF-β), типа использованного стента, особенностей гиполипидемической терапии, продолжительности заболевания, коморбидных состояний.
За последние годы в медицинской литературе опубликованы убедительные данные о том, что Лп(а) превосходит по своему атерогенному потенциалу холестерин липопротеидов низкой плотности (ХС ЛНП) в 6,6 раз в пересчёте на одну частицу [7]. Патогенетическая роль Лп(а) реализуется через три основных механизма: непосредственное влияние на прогрессирование атеросклероза, неспецифическое воспаление и атеротромбоз [8]. VEGF способствует ангиогенезу и воспалению, стимуляции пролиферации и миграции эндотелиальных клеток, что приводит к неоваскуляризации в атеросклеротических бляшках. Кроме того, VEGF взаимодействует с другими медиаторами воспаления, усиливая воспалительный ответ в сосудистой стенке, что также ассоциировано с прогрессированием атеросклероза [9][10].
TGF-β, согласно публикациям, может как ингибировать, так и стимулировать развитие атеросклероза. Например, в некоторых исследованиях отмечается, что TGF-β способствует стабилизации атеросклеротических бляшек, уменьшая риск их разрыва и последующих тромбозов, в то время как другие исследования указывают на его роль в усилении воспалительной реакции и прогрессировании атеросклероза [11-13]. С учётом того, что ежегодно по всему миру устанавливают миллионы стентов, возникновение рестеноза в стенте может значительно влиять на медицинскую систему [14][15].
Цель — изучить взаимосвязь между уровнями Лп(а), VEGF, TGF-β в плазме крови, достижением целевого уровня ХС ЛНП на фоне гиполипидемической терапии и возникновением рестеноза стента после ЧКВ у пациентов с ИБС.
Материал и методы
Селективная коронарная ангиография (СКГ) выполнена у 92 пациентов исходно при госпитализации и через 1-2 мес. после перенесённого острого коронарного синдрома (ОКС) для последовательной реваскуляризации миокарда. В период проспективного наблюдения группы формировали из пациентов, которым проводили СКГ во время ОКС с восстановлением просвета инфаркт-связанной артерии и как результат с достижением дистального кровотока по TIMI III. Использовали стенты 2 поколения с лекарственным покрытием и без него. Во время СКГ оценивали кровоток в остальных коронарных артериях. Если у пациента был гемодинамически значимый стеноз коронарной артерии на 70-90%, не связанный с ОКС, его направляли на консультацию к кардиологу через 1 мес. Целью консультации было решение вопроса о реваскуляризации миокарда с учётом результатов нагрузочного тестирования и клинического состояния пациента. Основные критерии направления на повторную СКГ и включения в исследование: клинически ассоциированный (жалобы на боль за грудиной) стеноз диаметра просвета коронарной артерии ≥70%; безболевая ишемия миокарда, зафиксированная по результатам стресс-эхокардиографии с формированием свежих зон гипокинезии; при применении тредмил-теста — патологические изменения сегмента ST (пациентам с клиническими проявлениями стенокардии нагрузочные тесты не проводили); стеноз коронарной артерии 90% без информации о повторном появлении стенокардии. Пациента госпитализировали в плановом порядке на повторную лечебную СКГ через 1-2 мес. После визуализации ранее установленного стента в инфаркт-связанную артерию с формирование неоинтимы, степени рестеноза внутри стента определяли и оценивали в плазме крови содержания Лп(а), VEGF, TGF-β, а также проводили анализ достижения целевых значений ХС ЛНП на фоне гиполипидемической терапии. Большинство пациентов имели в анамнезе не только впервые ранее выявленные симптомы ИБС, но и хроническое течение в виде стенокардии напряжения I-II функционального класса (n=29) с продолжительностью >6 мес.
У 49 пациентов по данным СКГ фиксировалось образование неоинтимы и рестеноза внутри стента с разными показателями повреждения нативной артерии (основная группа) (табл. 1). Основным признаком рестеноза было сужение в области стента ≥10% просвета сосуда внутри стента или формирование неоинтимы в ранние сроки (1-2 мес.) после ОКС, подтверждённое ангиографически. Рестеноз определяли инвазивным методом под рентгенологическим контролем посредством контрастной катетеризации просвета артерии. Ввиду отсутствия достоверных данных о признаках рестеноза, выраженных в процентах, минимальный порог, который указывали в протоколах, составил 10%. В группу сравнения включены 43 пациента без рестеноза стента по данным СГК (см. табл. 1). Больные были сопоставимы по полу и возрасту с пациентами основной группы, наблюдался высокий уровень приверженности лечению, нарушений в режиме приёма лекарственных препаратов не отмечено.
Критерии исключения: хроническая болезнь почек (скорость клубочковой фильтрации <30 мл/мин/1,73 м2), системные заболевания соединительной ткани, заболевания кроветворной системы, хронические воспалительные заболевания в стадии обострения, ВИЧ-инфекция, вирусные гепатиты В и С. Проспективное наблюдение через 1 мес. после развития ОКС включало анализ структуры коморбидной патологии, гиполипидемической терапию, липидного спектра (общий холестерин, триглицериды, ХС ЛНП). Липопротеин(а) измеряли ферментативным колориметрическим методом на биохимическом анализаторе Olympus AU480. Для определения уровня VEGF, TGF-β образцы крови из локтевой вены были центрифугированы (15 000 об./мин) и подвергнуты глубокой заморозке при температуре -18 °C. Хранение образцов осуществляли в условиях глубокой заморозки. Уровень TGF-β и VEGF определяли методом иммуноферментного анализа с использованием стандартных тест-систем. Референсные значения определяли в соответствии с международными рекомендациями (Clinical and Laboratory Standards Institute) на выборке 25 здоровых лиц, стратифицированных по полу и возрасту. Границы нормативных значений сопоставимы со значениями, указанными в инструкциях, прилагаемых к диагностическим наборам. Для VEGF нормальным значением является уровень в плазме крови <691 мМЕ/мл. Нормальный уровень TGF-β установлен в зависимости от возраста пациента (табл. 2).
Запись электрокардиограммы покоя проводили в 12 отведениях. Наличие нарушений локальной сократимости миокарда выявляли с помощью трансторакальной эхокардиографии в покое.
Критериями, указывающими на прогрессирование коронарного атеросклероза внутри стента, были: появление субокклюзии внутри стента в исходно проходимом сегменте; появление новых рестенозов 10-30% в исходно в проходимом сегменте; появление новых рестенозов 40-50% в исходно проходимом сегменте; появление новых рестенозов >70% в исходно проходимом сегменте; раннее формирование неоинтимы внутри стента [14]. СКГ выполняли в двух ортогональных ракурсах с предшествующим введением внутрикоронарного нитроглицерина (200 мг). Анализ ангиограмм проводили специалистами отделения рентгенохирургических методов диагностики и лечения заболеваний сердца и сосудов с использованием стационарного ангиографического комплекса Advantx LCV+ фирмы "Дженерал-Электрик" (США).
Целевой уровень ХС ЛНП для данной группы в соответствии с актуальными клиническими рекомендациями, одобренными Научно-практическим советом Минздрава России "Нарушение липидного обмена" (2023), составляет <1,4 ммоль/л [15].
Согласно консенсусу Европейского общества атеросклероза (EAS), нормальным уровнем Лп(а) считается значение <30 мг/дл (или <75 нмоль/л), промежуточным — от 30 до 50 мг/дл (или от 75 до 125 нмоль/л), и повышенным — >50 мг/дл (или >125 нмоль/л) [16]. Однако появляются данные, что риск неблагоприятного сердечно-сосудистого исхода увеличивался с повышением уровня ЛП(а) от 24 до 30 мг/дл в общей популяции [17][18]. В этой связи в исследовании за нормальное значение предложено рассматривать уровень Лп(а) в плазме крови <30 мг/дл. В ходе проведения анализа полученных данных наблюдалось статистически значимое увеличение частоты рестенозов при уровне Лп(а) >18 мг/дл, поэтому данное значение учитывали в выводах.
В группе включённых в исследование пациентов (92 человека) проанализировано 184 образца крови. Все пациенты проходили стандартное лечение, которое включало тикагрелор или клопидогрел, аторвастатин, ацетилсалициловую кислоту либо антикоагулянты (если у пациента в анамнезе была фибрилляция предсердий), β-блокаторы и ингибиторы ангиотензин-превращающего фермента или антагонисты рецепторов ангиотензина II. В зависимости от клинической ситуации, врачи могли назначать антиангинальные, антигипертензивные препараты, ангиотензиновых рецепторов и неприлизина ингибитор.
Исследование соответствует стандартам надлежащей клинической практики (Good Clinical Practice) и принципам Хельсинкской декларации. Проведение исследования одобрил этический комитет ФГБОУ ВО "Воронежский государственный медицинский университет им. Н. Н. Бурденко" Минздрава России (протокол №7 от 08.10.2021). Все пациенты были ознакомлены с целями и основными положениями исследования, дали информированное согласие на участие в исследовании.
Статистический анализ
Количественные показатели предварительно проверяли на соответствие нормальному закону распределения с помощью критерия Шапиро–Уилка. Количественные переменные представлены медианами и межквартильным размахом: Me [Q1;Q3]. Сравнение количественных показателей в двух независимых выборках проводили с помощью критерия Манна–Уитни, более чем в двух — критерием Краскела–Уоллиса с парными сравнениями (post-hoc) с помощью критерия Данна. Качественные признаки представлены как абсолютные и относительные (%) частоты. Сравнения двух групп по качественным номинальным показателям проводили в ходе анализа таблиц сопряжённости критерием Хи-квадрат Пирсона (χ2). Для слабонасыщенных таблиц (имелись ячейки со значениями ≤5) оценку статистической значимости различий проводили с помощью точного критерия Фишера. Для выявления категорий, внёсших неслучайный вклад в статистику критерия, рассчитывали согласованные стандартизованные остатки Хабермана. В случае нескольких групп парный анализ проводили критерием Хи-квадрат (точным критерием Фишера при необходимости) с применением поправки Беньямини–Хохберга. Также поправка Беньямини–Хохберга на множественные сравнения применяли при использовании критерия Данна и расчёте стандартизованных остатков Хабермана. В качестве меры размера величины эффекта рассчитывали отношение шансов (ОШ) и 95% доверительный интервал (ДИ). Результаты считали статистически значимыми при p<0,05. Все расчёты проводили в статистической среде R (v.3.6, лицензия GNU GPL2).
Таблица 1. Сравнительная характеристика пациентов на момент развития ОКС
Показатель | Вся выборка (n=92) | Наличие рестеноза | p-value1 | ||
нет (n=43) | есть (n=49) | ||||
Возраст, лет (Me [Q1; Q3]) | 64,0 [ 57,8; 68,0] | 64,0 [ 58,0; 67,0] | 65,0 [ 57,0; 69,0] | 0,47 | |
Пол, n (٪) | M | 73 (79,35) | 31 (72,09) | 42 (85,71) | 0,11 |
Ж | 19 (20,65) | 12 (27,91) | 7 (14,29) | ||
СД, n (٪) | 25 (27,17) | 12 (27,91) | 13 (26,53) | 0,88 | |
АГ, n (٪) | 81 (88,04) | 38 (88,37) | 43 (87,76) | 0,93 | |
ПИКС, n (٪) | 73 (79,35) | 35 (81,40) | 38 (77,55) | 0,65 | |
ОНМК, n (٪) | 8 (8,70) | 4 (9,30) | 4 (8,16) | 1,00 | |
Стабильная ИБС, n (٪) | 29 (31,52) | 8 (18,60) | 21 (42,86) | 0,01 | |
ФП, n (٪) | 14 (15,22) | 9 (20,93) | 5 (10,20) | 0,15 | |
ХОБЛ, n (٪) | 1 (1,09) | 0 (0) | 1 (2,04) | 1,00 | |
БА, n (٪) | 2 (2,17) | 2 (4,65) | 0 (0) | 0,22 | |
Перенесённое онкологическое заболевание, n (٪) | 1 (1,09) | 1 (2,33) | 0 (0) | 0,47 | |
ХБП 3А, n (٪) | 21 (22,83) | 5 (11,63) | 16 (32,65) | 0,02 | |
COVID-19, n (٪) | 18 (19,57) | 12 (27,91) | 6 (12,24) | 0,06 | |
ОХС, ммоль/л (Me [Q1; Q3]) | 5,0 [ 4,1; 5,8] | 5,1 [ 4,1; 6,0] | 4,9 [ 4,1; 5,7] | 0,79 | |
ХС ЛНП, ммоль/л (Me [Q1; Q3]) | 3,1 [ 2,3; 3,7] | 3,2 [ 2,4; 3,7] | 3,1 [ 2,2; 3,6] | 0,43 | |
Поражение ПНА, n (٪) | 53 (57,61) | 25 (58,14) | 28 (57,14) | 0,92 | |
Поражение ПКА, n (٪) | 31 (33,70) | 12 (27,91) | 19 (38,78) | 0,27 | |
Поражение ОА, n (٪) | 19 (20,65) | 9 (20,93) | 10 (20,41) | 0,95 | |
Продолжительность ИБС, годы (Me [Q1; Q3]) | 4,0 [ 2,0; 6,0] | 2,0 [ 2,0; 4,0] | 6,0 [ 4,0; 11,0] | <0,001 | |
Категории по ИМТ, n (٪) | Норма | 26 (28,26) | 12 (27,91) | 14 (28,57) | 0,79 |
Избыток массы тела | 34 (36,96) | 18 (41,86) | 16 (32,65) | ||
Ожирение 1 ст. | 24 (26,09) | 10 (23,26) | 14 (28,57) | ||
Ожирение 2 ст. | 8 (8,70) | 3 (6,98) | 5 (10,20) | ||
Тип стента, n (٪) | BMS | 58 (63,04) | 19 (44,19) | 39 (79,59) | <0,001 |
DES | 34 (36,96) | 24 (55,81) | 10 (20,41) | ||
Прием аторвастатина, n (٪) | 20 мг | 3 (3,26) | 2 (4,65) | 1 (2,04) | 0,25 |
40 мг | 75 (81,52) | 33 (76,74) | 42 (85,71) | ||
80 мг | 12 (13,04) | 8 (18,60) | 4 (8,16٪) | ||
Нет | 2 (2,17) | 0 (0) | 2 (4,08) | ||
1Применялся критерий Манна–Уитни для количественных показателей и критерий x2 (точный критерий Фишера при необходимости) для категориальных АГ — артериальная гипертония, БА — бронхиальная астма, ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, ОА — огибающая артерия, ОКС — острый коронарный синдром, ОНМК — острое нарушение мозгового кровообращения, ОХС — общий холестерин, ПИКС — постинфарктный кардиосклероз, ПКА — правая коронарная артерия, ПНА — передняя нисходящая артерия, СД — сахарный диабет, ФП — фибрилляция предсердий, ХБП — хроническая болезнь почек, ХОБЛ — хроническая обструктивная болезнь легких, ХС ЛНП — липопротеиды низкой плотности, BMS — bare-metal stent (стент без лекарственного покрытия), DES — drug eluting stent (стент с лекарственным покрытием) | |||||
Таблица 2. Референтные значения для здоровых лиц TGF-β
Возраст пациента, годы | Норма TGF-β, нг/мл |
21-30 | 23,73-70,94 |
31-40 | 24,09-58,94 |
41-50 | 20,36-67,09 |
51-60 | 18,77-63,56 |
61-70 | 25,55-49,86 |
TGF-β — трансформирующий фактор роста β | |
Таблица 3. Сравнительная характеристика групп исследования через 1 мес. после ОКС
Показатель | Вся выборка (n=92) | Наличие рестеноза | p-value1 | ||
нет (n=43) | есть (n=49) | ||||
ОХС, ммоль/л | Me [Q1;Q3] | 3,7 [ 3,2;4,3] | 3,8 [ 3,4;4,3] | 3,5 [ 3,0;4,2] | 0,07 |
ХС ЛНП, ммоль/л | Me [Q1;Q3] | 1,9 [ 1,4;2,4] | 2,1 [ 1,5;2,6] | 1,9 [ 1,4;2,3] | 0,23 |
Достигнут целевой уровень (<1,4), n (٪) | 20 (21,74) | 7 (16,28) | 13 (26,53) | 0,23 | |
Нет (≥1,4), n (٪) | 72 (78,26) | 36 (83,72) | 36 (73,47) | ||
Лп(а), мг/дл | Me [Q1;Q3] | 10,9 [ 2,8;24,5] | 5,1 [ 2,2;13,3] | 19,2 [ 6,1;48,1] | <0,001 |
Выше 18, n (٪) | 33 (35,87) | 7 (16,28) | 26 (53,06) | <0,001 | |
Ниже 18, n (٪) | 59 (64,13) | 36 (83,72) | 23 (46,94) | ||
Выше 30, n (٪) | 24 (26,09) | 6 (13,95) | 18 (36,73) | 0,01 | |
Ниже 30, n (٪) | 68 (73,91) | 37 (86,05) | 31 (63,27) | ||
TGF-β, нг/мл | Me [Q1;Q3] | 58,2 [ 43,7;73,0] | 52,0 [ 45,1;75,7] | 58,8 [ 43,6;70,8] | 0,88 |
Выше нормы, n (٪) | 50 (54,35) | 21 (48,84) | 29 (59,18) | 0,32 | |
Норма | 42 (45,65) | 22 (51,16) | 20 (40,82) | ||
VEGF, мМЕ/мл | Me [Q1;Q3] | 249,6 [ 141,6;376,0] | 247,9 [ 135,1;368,1] | 251,3 [ 145,5;384,5] | 0,64 |
Выше нормы, n (٪) | 7 (7,61) | 1 (2,33) | 6 (12,24) | 0,12 | |
Норма, n (٪) | 85 (92,39) | 42 (97,67) | 43 (87,76) | ||
1Применялся критерий Манна–Уитни для количественных показателей и критерий x2 (точный критерий Фишера при необходимости) для категориальных Лп(а) — липопротеин (а), ОКС — острый коронарный синдром, ОХС — общий холестерин, ХС ЛНП — липопротеиды низкой плотности, TGF-β — трансформирующий фактор роста β, VEGF — фактор роста эндотелия сосудов | |||||
Таблица 4. Частота встречаемости отдельных комбинаций показателей (относительно нормативных значений) в группах исследования
Комбинация показателей | Без рестеноза (n=43) | Рестеноз (n=49) | p-value1 | Post hoc | |
ХС ЛНП и Лп(а) (>/< 18 мг/дл), n (٪) | Целевой уровень ХС ЛНП не достигнут, Лп(а) ≥18 мг/дл | 7 (16,3) | 19 (38,8) | 0,002 | 0,05 |
Целевой уровень ХС ЛНП не достигнут, Лп(а) <18 мг/дл | 29 (67,4) | 17 (34,7) | 0,007 | ||
Целевой уровень ХС ЛНП достигнут, Лп(а) ≥18 мг/дл | 0 (0) | 7 (14,3) | 0,04 | ||
Целевой уровень ХС ЛНП достигнут, Лп(а) <18 мг/дл | 7 (16,3) | 6 (12,2) | 1,00 | ||
ХС ЛНП и Лп(а) (>/< 30 мг/дл), n (٪) | Целевой уровень ХС ЛНП не достигнут, Лп(а) ≥30 мг/дл | 6 (14,0) | 13 (26,5) | 0,041 | 0,14 |
Целевой уровень ХС ЛНП не достигнут, Лп(а) <30 мг/дл | 30 (69,8) | 23 (46,9) | 0,03 | ||
Целевой уровень ХС ЛНП достигнут, Лп(а) ≥30 мг/дл | 0 (0) | 5 (10,2) | 0,03 | ||
Целевой уровень ХС ЛНП достигнут, Лп(а) <30 мг/дл | 7 (16,3) | 8 (16,3) | 0,95 | ||
ХС ЛНП и VEGF, n (٪) | Целевой уровень ХС ЛНП не достигнут, Лп(а) ≥30 мг/дл | 0 (0) | 3 (6,1) | 0,23 | |
Целевой уровень ХС ЛНП не достигнут, Лп(а) <30 мг/дл | 7 (16,3) | 10 (20,4) | |||
Целевой уровень ХС ЛНП не достигнут, VEGF не норма | 1 (2,3) | 3 (6,1) | |||
Целевой уровень ХС ЛНП не достигнут, VEGF норма | 35 (81,4) | 33 (67,3) | |||
ХС ЛНП и TGF, n (٪) | Целевой уровень ХС ЛНП не достигнут, Лп(а) ≥30 мг/дл | 6 (14,0) | 7 (14,3) | 0,11 | |
Целевой уровень ХС ЛНП не достигнут, Лп(а) <30 мг/дл | 1 (2,3) | 6 (12,2) | |||
Целевой уровень ХС ЛНП не достигнут, TGF-β не норма | 15 (34,9) | 22 (44,9) | |||
Целевой уровень ХС ЛНП не достигнут, TGF-β норма | 21 (48,8) | 14 (28,6) | |||
Лп(а) и VEGF (>/< 18 мг/дл), n (٪) | Лп(а) ≥18 мг/дл, VEGF не норма | 1 (2,3) | 2 (4,1) | <0,001 | 0,65 |
Лп(а) ≥18 мг/дл, VEGF норма | 6 (14,0) | 24 (49,0) | <0,001 | ||
Лп(а) <18 мг/дл, VEGF не норма | 0 (0) | 4 (8,2) | 0,05 | ||
Лп(а) <18 мг/дл, VEGF норма | 36 (83,7) | 19 (38,8) | <0,001 | ||
Лп(а) и VEGF (>/< 30 мг/дл), n (٪) | Лп(а) ≥30 мг/дл, VEGF не норма | 1 (2,3) | 2 (4,1) | 0,010 | 1,00 |
Лп(а) ≥30 мг/дл, VEGF норма | 5 (11,6) | 16 (32,7) | 0,05 | ||
Лп(а) <30 мг/дл, VEGF не норма | 0 (0) | 4 (8,2) | 0,22 | ||
Лп(а) <30 мг/дл, VEGF норма | 37 (86,0) | 27 (55,1) | 0,005 | ||
Лп(а) и TGF-β (>/< 18 мг/дл), n (٪) | Лп(а) ≥18 мг/дл, TGF-β не норма | 4 (9,3) | 17 (34,7) | 0,003 | 0,02 |
Лп(а) <18 мг/дл, TGF-β норма | 3 (7,0) | 9 (18,4) | 0,42 | ||
Лп(а) ≥18 мг/дл, TGF-β не норма | 17 (39,5) | 12 (24,5) | 0,48 | ||
Лп(а) <18 мг/дл, TGF-β норма | 19 (44,2) | 11 (22,4) | 0,03 | ||
Лп(а) и TGF-β (>/< 30 мг/дл), n (٪) | Лп(а) ≥30 мг/дл, TGF-β не норма | 4 (9,3) | 9 (18,4) | 0,031 | 0,85 |
Лп(а) ≥30 мг/дл, TGF-β норма | 2 (4,7) | 9 (18,4) | 0,17 | ||
Лп(а) <30 мг/дл, TGF-β не норма | 17 (39,5) | 20 (40,8) | 1,00 | ||
Лп(а) <30 мг/дл, TGF-β норма | 20 (46,5) | 11 (22,4) | 0,05 | ||
VEGF и TGF-β, n (%) | VEGF не норма, TGF не норма | 0 (0) | 3 (6,1) | 0,21 | |
VEGF не норма, TGF норма | 1 (2,3) | 3 (6,1) | |||
VEGF норма, TGF не норма | 21 (48,8) | 26 (53,1) | |||
VEGF норма, TGF норма | 21 (48,8) | 17 (34,7) | |||
1Применялся критерий x2, для выявления ячеек таблицы, давших неслучайный вклад в статистику критерия, рассчитывали согласованные стандартизованные остатки Хабермана с поправкой Беньямини–Хохберга (post hoc) Лп(а) — липопротеин (а), ХС ЛНП — липопротеиды низкой плотности, TGF-β — трансформирующий фактор роста β, VEGF — фактор роста эндотелия сосудов | |||||
Результаты
В группе пациентов с развитием рестеноза статистически значимо чаще регистрировали пациентов с продолжительным течением хронической формы ИБС (стенокардия напряжения I-II функционального класса, постинфарктный кардиосклероз), стабильной ИБС, хронической болезни почек (ХБП) 3А и применением стента BMS (стента без лекарственного покрытия). В группе с рестенозом медиана продолжительности ИБС составила 6,0 (4,0; 11,0) мес. vs 2,0 (2,0; 4,0) мес. в группе без рестеноза (p<0,001) (рис. 1). Стабильная ИБС зарегистрирована у 42,86% (n=21) пациентов с рестенозом vs 18,6% (n=8) у пациентов без рестеноза (p=0,01) (рис. 2). В группе с рестенозом у 32,65% (n=16) зарегистрирована ХБП 3A стадии vs 11,63% (n=5) пациентов без рестеноза (p=0,02) (рис. 3).
В группе с рестенозом доля пациентов со стентом BMS составила 79,59% (n=39) vs 44,19% (n=19) в группе без рестеноза (p<0,001) (рис. 4).
В группе с рестенозом был статистически значимо выше уровень Лп(а) — 19,2 (6,1; 48,1) мг/дл vs 5,1 (2,2; 13,3) мг/дл (p<0,001), в том числе выше доля пациентов с уровнем Лп(а) >30 мг/дл — 36,73% (n=18) vs 13,95% (n=6), p=0,01 и >18 мг/дл — 53,06% (n=26) vs 16,28% (n=7), p<0,001 (рис. 5).
У пациентов с рестенозом по сравнению с пациентами без рестеноза статистически значимо чаще встречался Лп(а) выше нормативного, даже при достижении целевых значений ХС ЛНП — 10,2% (n=5) vs 0% (p=0,03).
При анализе распределения Лп(а) относительно уровня 18 мг/дл выявлено: при рестенозе статистически значимо чаще встречались пациенты с показателем Лп(а) >18 мг/дл, независимо от достижения целевых значений ХС ЛНП — Лп(а) >18 мг/дл при достижении ХС ЛНП отмечен у 14,3% (n=7) пациентов с рестенозом vs 0% у пациентов без рестеноза (p=0,04). Лп(а) >18 мг/дл при недостигнутом ХС ЛНП зарегистрирован у 38,8% (n=19) пациентов с рестенозом vs 16,3% (n=7) у пациентов без рестеноза (p=0,05).
В группе пациентов с рестенозом статистически значимо реже встречались пациенты, у которых Лп(а) и VEGF одновременно были в пределах нормы — Лп(а) 55,1% (n=27) vs 86,0% (n=37) у пациентов без рестеноза (p=0,005). При этом в группе с рестенозом чаще встречались пациенты с уровнем Лп(а), превышающим нормативы даже при VEGF в пределах нормативных значений — 32,7% (n=16) vs 11,6% (n=5), p=0,05.
При анализе распределения Лп(а) относительно уровня 18 мг/дл выявлено, что рестеноз ассоциирован с превышением любого из показателей — Лп(а) и VEGF. Лп(а), превышающий 18 мг/дл, при VEGF в пределах нормы встречался у 49% (n=24) пациентов с рестенозом vs 14% (n=6) пациентов без рестеноза (p<0,001). При этом превышение VEGF при Лп(а) <18 мг/дл также ассоциировано с рестенозом и такая комбинация показателей встречалась у 8,2% (n=4) пациентов с рестенозом vs 0% в группе без рестеноза (p=0,05).
При анализе TGF-β и Лп(а) выявлено, что нахождение в границах нормативных значений обоих показателей одновременно статистически значимо реже наблюдалось в группе пациентов с рестенозом по сравнению с пациентами без рестеноза — 22,4% (n=11) vs 44,2% (n=19), p=0,03.
Анализ Лп(а) относительно границы 18 мг/дл показал, что наличие рестеноза ассоциировано с превышением сразу обоих показателей TGF-β и Лп(а) (>18 мг/дл). У 34,7% (n=17) пациентов с рестенозом сразу оба показателя (TGF-β и Лп(а)) были повышены (TGF-β выше нормы, Лп(а) >18 мг/дл) vs 9,3% (n=4) в группе без рестеноза (p=0,02).
У больных в группе с рестенозом был статистически значимо выше уровень Лп(а) >30 мг/дл, даже при достижении целевых значений ХС ЛНП. Статистически значимым оказался показатель Лп(а) при пороговым значении >18 мг/дл, независимо от достижения целевых значений ХС ЛНП.
При анализе VEGF, TGF-β и Лп(а) выявлено, что нахождение в границах нормативных значений данных показателей статистически значимо реже наблюдалось в группе пациентов с рестенозом.
Таким образом, развитие рестеноза ассоциировано с большей продолжительностью ИБС (ОШ=2,6 [ 95% ДИ 1,31-6,3] — (с шагом увеличения продолжительности 10 мес.), стабильной ИБС (ОШ=3,3 [ 95% ДИ 1,26-8,5]), наличием у пациента ХБП 3А (ОШ=3,7 [ 95% ДИ 1,22-11,1]), стентом BMS (ОШ=5,0 [ 95% ДИ 2,0-12,5]), уровнем Лп(а) (ОШ=1,3 [ 95% ДИ 1,04-1,52]) (при увеличении уровня Лп(а) с шагом в 10 мг/дл), в том числе с уровнем Лп(а) >30 мг/дл (ОШ=3,6 [ 95% ДИ 1,2-10,1]) и >18 мг/дл (ОШ=5,9 [ 95% ДИ: 2,17-16,6]) (рис. 6).
Уровень Лп(а) выше нормативного ассоциирован с увеличением вероятности рестеноза, даже при достижении целевых значений ХС ЛНП (ОШ=13,1 [ 95% ДИ 1,0-246,1]) по сравнению с Лп(а) в пределах нормативных значений. При этом выявлено, что рестеноз ассоциирован с уровнем Лп(а) >18 мг/дл как у пациентов, достигших целевого уровня ХС ЛНП (ОШ=23,3 [ 95% ДИ 1,27-427,4]), так и у пациентов, не достигших целевого уровня (ОШ=4,25 [ 95% ДИ 1,5-11,7]) по сравнению с пациентами с уровнем Лп(а) <18 мг/дл (рис. 7).
При анализе TGF-β и Лп(а) отмечено, что нахождение в границах нормативных значений обоих указанных показателей одновременно является протективным фактором относительно развития рестеноза (ОШ=0,2 [ 95% ДИ 0,07-0,56]) по сравнению с любыми другими комбинациями указанных показателей. Также выявлено, что вероятность рестеноза увеличивается при одновременном повышении уровня Лп(а) >18 мг/дл и TGF выше нормативного — ОШ=7,2 [ 95% ДИ 2,0-27,4] (рис. 8).
Установлено, что нахождение в пределах нормы Лп(а) и VEGF является протективным фактором развития рестеноза (ОШ=0,33 [ 95% ДИ 0,14-0,82]) — по сравнению с любыми другими комбинациями указанных показателей) (см. рис. 7). При этом развитие рестеноза ассоциировано с повышенным уровнем любого из двух показателей: как превышение Лп(а) >18 мг/дл при VEGF в пределах нормы (ОШ=7,7 [ 95% ДИ 2,6-20]), так и превышение VEGF при Лп(а) <18 мг/дл (ОШ=16,8 [ 95% ДИ 1,0-329]) (см. рис. 8).
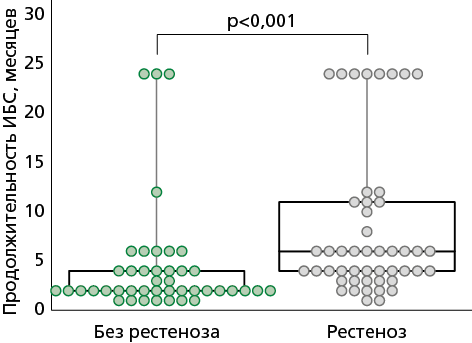
Рисунок 1. Продолжительность ИБС в группах исследования, приведены индивидуальные значения, Me [Q1; Q3], min-max.

Рисунок 2. Частота стабильной ИБС в группах исследования.
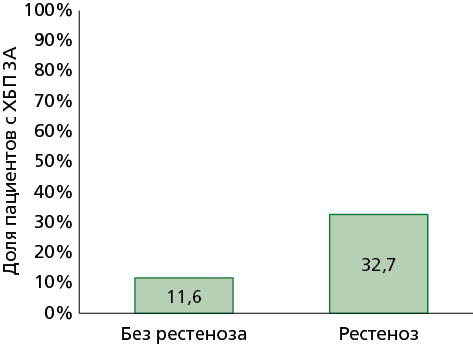
ХБП — хроническая болезнь почек
Рисунок 3. Частота ХБП 3А в группах исследования.
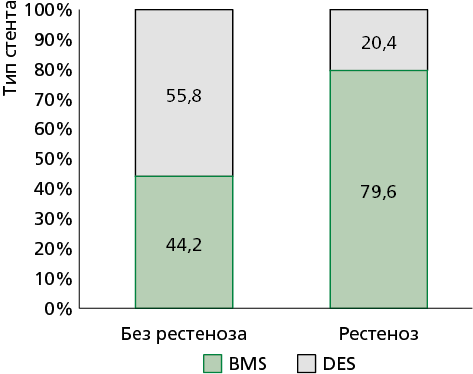
BMS — bare-metalic stent (стент без лекарственного покрытия), DES — drug eluting stent (стент с лекарственным покрытием)
Рисунок 4. Частота каждого типа стента в группах исследования.
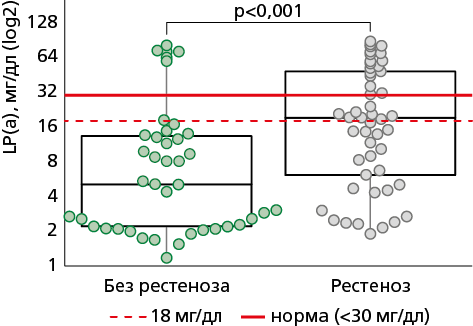
Lp(a) — липопротеин (а)
Рисунок 5. Лп(а) в группах исследования, приведены индивидуальные значения, Me [Q1;Q3], min-max.

ДИ — доверительный интервал, ИБС — ишемическая болезнь сердца, Лп(а) — липопротеин (а), ОШ — отношение шансов, ХБП — хроническая болезнь почек, ХС ЛНП — липопротеиды низкой плотности, BMS — bare-metal stent (стент без лекарственного покрытия)
Рисунок 6. ОШ развития рестеноза для отдельных показателей.

1По сравнению с пациентами с Лп(а) в пределах нормы
2По сравнению с пациентами с Лп(а) и VEGF в пределах нормы
3По сравнению с пациентами с Лп(а) и TGF-β в пределах нормы
ДИ — доверительный интервал, Лп(а) — липопротеин (а), ОШ — отношение шансов, ХС ЛНП — липопротеиды низкой плотности, TGF-β — трансформирующий фактор роста β, VEGF — фактор роста эндотелия сосудов
Рисунок 7. ОШ развития рестеноза для комбинации показателей с Лп(а) (<30 мг/дл).
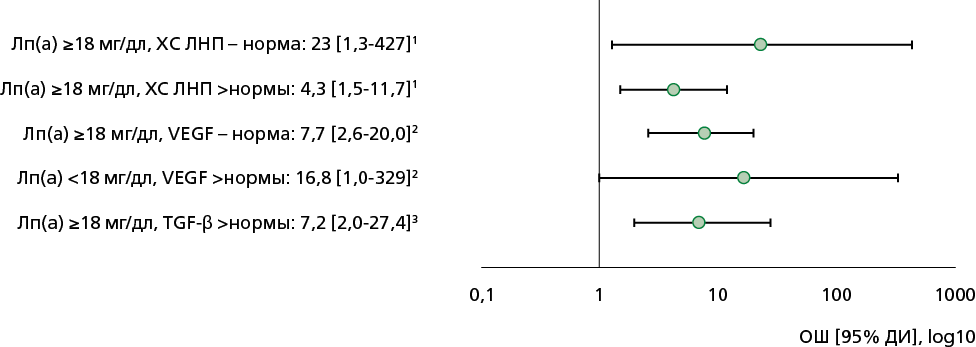
1По сравнению с пациентами с Лп(а) <18 мг/дл
2По сравнению с пациентами с Лп(а) <18 мг/дл и VEGF в пределах нормы
3По сравнению с пациентами с Лп(а) <18 мг/дл и TGF-β в пределах нормы
ДИ — доверительный интервал, Лп(а) — липопротеин (а), ОШ — отношение шансов, ХС ЛНП — липопротеиды низкой плотности, TGF-β — трансформирующий фактор роста β, VEGF — фактор роста эндотелия сосудов
Рисунок 8. ОШ развития рестеноза для комбинации показателей с Лп(а) (18 мг/дл).
Обсуждение
Настоящее исследование демонстрирует, что развитие рестеноза внутри стента ассоциировано с продолжительным течением ИБС, со стабильными формами ИБС, ХБП 3А стадии и типом стента BMS (без лекарственного покрытия), повышенным уровнем Лп(а), в том числе с превышением уровня Лп(а) >30 мг/дл, независимо от достижения целевого уровня ХС ЛНП <1,4 ммоль/л. Многочисленные рандомизированные исследования, изучающие сравнительную эффективность непокрытых стентов и стентов с лекарственным покрытием, доказали радикальное снижение частоты рестеноза в отдалённом периоде при имплантации стентов с лекарственным покрытием [19]. Исследование рестеноза после ЧКВ с использованием стентов без лекарственного покрытия (BMS) или стентов с лекарственным покрытием первого или второго поколения (DES) в больших масштабах (10 004 пациента) в двух центрах Мюнхена (Германия) продемонстрировало, что использование DES первого поколения по сравнению с голометаллическими (ОШ=0,35 [ 95% ДИ 0,31-0,39]) и DES второго поколения по сравнению с DES первого поколения (ОШ=0,67 [ 95% ДИ 0,58-0,77]) были независимыми предикторами более низкой частоты рестеноза [19]. В этом же исследовании перенесённое в анамнезе аортокоронарное шунтирование (отношение рисков 1,38 [ 95% ДИ 1,20-1,58]) было независимо связано с рестенозом, что ассоциировано с более продолжительным течением и со стабильными формами ИБС. В отношении ЛП(а) за несколько десятилетий написано множество статей и проведено достаточное количество исследований по влиянию данного лабораторного показателя на прогрессирование атеросклероза [20-22]. ЛП(а) однозначно влияет на темп развития атеросклероза, но в отношении развития рестноза стента есть разные данные. В одном исследовании спустя год после выполнения имплантации стента рестеноз, по данным повторной коронароангиографии, обнаружили у 38 (35%) из 109 пациентов. Концентрация Лп(a) в группе рестеноза (30,5±23,9 мг/дл) была статистически значимо выше, чем в группе без него — 16,9±11,1 мг/дл (p <0,01), тогда как значения других липидов были сопоставимыми [23]. В других исследованиях связи между уровнем Лп(а) и наличием рестеноза после имплантации BMS не установлено [24-26]. Лп(а) стимулирует пролиферацию гладкомышечных клеток, и по данным N. Bogavac-Stanojevic и соавт., снижение активации TGF-β1 приводит также к снижению экспрессии гена синтетазы оксида азота и ухудшению способности сосудистой стенки к релаксации [27]. Экспериментальные исследования доказали важную VEGF и TGF-β1 в формировании неоинтимы и развитии рестеноза [28]. Оба механизма признаны значимыми в процессе развития атеросклероза, но сочетание этих факторов при прогрессировании атеросклероза с формированием рестеноза стента изучено мало. В проведённом исследовании сочетание комбинаций TGF-β и Лп(а) (ОШ=0,2 [ 95% ДИ 0,07-0,56]) или VEGF и Лп(а) (ОШ=0,33 [ 95% ДИ 0,14-0,82]) в границах нормативных значений обоих указанных показателей одновременно является протективным фактором относительно развития рестеноза по сравнению с любыми другими комбинациями указанных показателей. В рамках наблюдения развитие рестеноза в стенте отмечали уже на границе Лп(а) >18 мг/дл. В исследовании с участием 483 пациентов, наблюдавшихся в течение 3 лет после выполнения у них успешного стентирования, продемонстрировано, что уровень Лп(а) >25 мг/дл значимо связан с возвратом клинических симптомов и прогрессированием атеросклероза до значимого поражения [29]. Возможно, референтные значения должны быть разными при первичной и вторичной профилактике сердечно-сосудистых осложнений.
Ограничения исследования
Ограничениями данного исследования являются проведение в одном центре и небольшой размер выборки. Чтобы подтвердить полученные выводы, будущие исследования должны включать более крупные группы. Кроме того, проспективные наблюдательные и интервенционные исследования могут дать более глубокое понимание долгосрочных преимуществ включения концентрации TGF-β и Лп(а) и VEGF в модели сердечно-сосудистого риска.
Заключение
Продолжительное течение ИБС, стабильная форма ИБС, ХБП 3А стадии и тип стента BMS, повышенный уровень Лп(а) >30 мг/дл, независимо от достижения целевого уровня ХС ЛНП <1,4 ммоль/л, значимо влияют на развитие рестеноза внутри стента. Необходимы дальнейшие исследования по оценке чувствительности, специфичности диагностических параметров развития неблагоприятных исходов атеросклеротических сердечно-сосудистых заболеваний. Следует отметить значимость определения концентрации TGF-β и Лп(а) и VEGF у больных, которым планируется выполнение ЧКВ, что может внести дополнительный вклад в оценку риска развития последующих коронарных осложнений.
Список литературы
1. Yi Y, Wang B, Li C. Sensors-based monitoring and treatment approaches for in-stent restenosis. J Biomed Mater Res B Appl Biomater. 2023;111(2):490-8. DOI:10.1002/jbm.b.35164.
2. Byrne RA, Joner M, Kastrati A. Stent thrombosis and restenosis: what have we learned and where are we going? The Andreas Gruntzig Lecture ESC 2014. Eur Heart J. 2015;36(47):3320-31. DOI:10.1093/eurheartj/ehv511.
3. Cassese S, Byrne RA, Schulz S, et al. Prognostic role of restenosis in 10004 patients undergoing routine control angiography after coronary stenting. Eur Heart J. 2015;36(2):94-9. DOI:10.1093/eurheartj/ehu383.
4. Шамес Д.В. Факторы риска рестенозов коронарных артерий при экстренном или плановом стентировании. Вестник современной клинической медицины. 2019;12(4):116-23. DOI:10.20969/VSKM.2019.
5. Turak O, Ozcan F, Isleyen A, et al. Usefulness of the neutrophil-to-lymphocyte ratio to predict bare-metal stent restenosis. Am J Cardiol. 2012;110(10):1405-10. DOI:10.1016/j.amjcard.2012.07.003.
6. Cho KI, Ann SH, Singh GB, et al. Combined Usefulness of the Platelet-toLymphocyte Ratio and the Neutrophil-to-Lymphocyte Ratio in Predicting the Long-Term Adverse Events in Patients Who Have Undergone Percutaneous Coronary Intervention with a Drug-Eluting Stent. PLoS One. 2015;10(7):e0133934. DOI:10.1371/journal.pone.0133934.
7. Björnson E, Adiels M, Taskinen MR, et al. Lipoprotein(a) Is Markedly More Atherogenic Than LDL: An Apolipoprotein B- B-Based Genetic Analysis. J Am Coll Cardiol. 2024;83(3):385-95. DOI:10.1016/j.jacc.2023.10.039.
8. Tsimikas S. Elevated lipoprotein(a) and the risk of stroke in children, young adults, and the elderly. Eur Heart J. 2021;42(22):2197-200. DOI:10.1093/eurheartj/ehab251.
9. Heinonen SE, Kivelä AM, Huusko J, et al. The effects of VEGF-A on atherosclerosis, lipoprotein profile, and lipoprotein lipase in hyperlipidaemic mouse models. Cardiovasc Res. 2013;99(4):716-23. DOI:10.1093/cvr/cvt148.
10. Dabravolski SA, Khotina VA, Omelchenko AV, et al. The Role of the VEGF Family in Atherosclerosis Development and Its Potential as Treatment Targets. Int J Mol Sci. 2022;23(2):931. DOI:10.3390/ijms23020931.
11. Toma I, McCaffrey TA. Transforming growth factor-β and atherosclerosis: interwoven atherogenic and atheroprotective aspects. Cell Tissue Res. 2012;347(1):155-75. DOI:10.1007/s00441-011-1189-3.
12. Grainger DJ. Transforming growth factor beta and atherosclerosis: so far, so good for the protective cytokine hypothesis. Arterioscler Thromb Vasc Biol. 2004;24(3):399-404. DOI:10.1161/01.ATV.0000114567.76772.33.
13. McCaffrey TA. TGF-beta signaling in atherosclerosis and restenosis. Front Biosci (Schol Ed). 2009;1(1):236-45. DOI:10.2741/s23.
14. Giustino G, Colombo A, Camaj A, et al. Coronary In-Stent Restenosis: JACC State-of-the-Art Review. J Am Coll Cardiol. 2022;80(4):348-72. DOI:10.1016/j.jacc.2022.05.017.
15. Ежов М.В., Кухарчук В.В., Сергиенко И.В. и др. Нарушения липидного обмена. Клинические рекомендации 2023. Российский кардиологический журнал. 2023;28(5):5471. DOI:10.15829/1560-4071-2023-5471.
16. Reyes-Soffer G, Ginsberg HN, Berglund L, et al. Lipoprotein(a): A Genetically Determined, Causal, and Prevalent Risk Factor for Atherosclerotic Cardiovascular Disease: A Scientific Statement From the American Heart Association. Arterioscler Thromb Vasc Biol. 2022;42(1):e48-e60. DOI:10.1161/ATV.0000000000000147.
17. Kamstrup PR, Tybjaerg-Hansen A, Steffensen R, et al. Genetically elevated lipoprotein(a) and increased risk of myocardial infarction. JAMA. 2009; 301(22):2331-9. DOI:10.1001/jama.2009.801.
18. Waldeyer C, Makarova N, Zeller T, et al. Lipoprotein(a) and the risk of cardiovascular disease in the European population: results from the BiomarCaRE consortium. Eur Heart J. 2017;38(32):2490-8. DOI:10.1093/eurheartj/ehx166.
19. Левицкий И.В., Самко А.Н., Меркулов Е.В. Второе поколение стентов с лекарственным покрытием. Атмосфера. Новости кардиологии. 2011;(3):17-21.
20. Цыганкова О.В., Бондарева К.И., Латынцева Л.Д., Старичкова А.А. Клиническая и патофизиологическая роль липопротеина (а) в развитии атеросклероз-ассоциированных заболеваний. РМЖ. 2020;28(12):4-8.
21. Marcovina SM, Koschinsky ML. Lipoprotein(a) as a risk factor for coronary artery disease. Am J Cardiol. 1998;82(12A):57U-66U; discussion 86U. DOI:10.1016/s0002-9149(98)00954-0.
22. Полякова Е.А., Халимов Ю.Ш., Баженова Е.А., Бахер Т.М. Липопротеин(а), атеросклероз и сердечно-сосудистый риск. Рациональная Фармакотерапия в Кардиологии. 2024;20(5):559-65. DOI:10.20996/1819-6446-2024-3080.
23. Cassese S Byrne RA, Tada T, et al. Incidence and predictors of restenosis after coronary stenting in 10004 patients with surveillance angiography. Heart. 2014;100(2):153-9. DOI:10.1136/heartjnl-2013-304933.
24. Kamitani T, Taniguchi T, Miyai N, et al. Association between plasma lipoprotein(a) concentration and restenosis after stent implantation. Circ J. 2005;69:644-9. DOI:10.1253/circj.69.644.
25. Zairis MN, Ambrose A, Manousakis SJ, et al. The impact of plasma levels of C-reactive protein, lipoprotein (a) and homocysteine on the long-term prognosis after successful coronary stenting: The Global Evaluation of New Events and Restenosis After Stent Implantation Study. J Am Coll Cardiol. 2002;40:1375-82. DOI:10.1016/s0735-1097(02)02267-2.
26. Gazzaruso C, Garzaniti A, Falcone C, et al. Restenosis after intracoronary stent placement: can apolipoprotein(a) polymorphism play a role? Int J Cardiol. 2003;87:91-8. DOI:10.1016/s0167-5273(02)00202-4.
27. Bogavac-Stanojevic N, Djurovic S, et al. Circulating trans forming growth factorbeta1, lipoprotein(a) and cellular adhesion molecules in angiographically assessed coronary artery disease. Clin Chem Lab Med. 2003;41(7):893-8. DOI:10.1515/CCLM.2003.135.
28. Jukema JW, Verschuren JJ, Ahmed TA, Quax PH. Restenosis after PCI. Part 1: pathophysiology and risk factors. Nat Rev Cardiol. 2011;9(1):53-62. DOI:10.1038/nrcardio.2011.132.
29. Smith SC Jr, Dove JT, Jacobs AK, et al.; American College of Cardiology/American Heart Association task force on practice guidelines (Committee to revise the 1993 guidelines for percutaneous transluminal coronary angioplasty); Society for Cardiac Angiography and Interventions. ACC/AHA guidelines for percutaneous coronary intervention (revision of the 1993 PTCA guidelines)-executive summary: a report of the American College of Cardiology/American Heart Association task force on practice guidelines (Committee to revise the 1993 guidelines for percutaneous transluminal coronary angioplasty) endorsed by the Society for Cardiac Angiography and Interventions. Circulation. 2001;103(24):3019-41. DOI:10.1161/01.cir.103.24.3019.
Об авторах
М. А. МешковаРоссия
Мешкова Мария Анатольевна, аспирант кафедры поликлиническая терапия
Воронеж
И. А. Стародубцева
Россия
Стародубцева Ирина Александровна, профессор кафедры поликлиническая терапия, доктор медицинских наук
Воронеж
А. А. Пашкова
Россия
Мешкова Мария Анатольевна, зав.кафедры поликлиническая терапия, доктор медицинских наук
Воронеж
Дополнительные файлы
Рецензия
Для цитирования:
Мешкова М.А., Стародубцева И.А., Пашкова А.А. Прогностические факторы рестеноза стента у пациентов с ишемической болезнью сердца, перенёсших чрескожное коронарное вмешательство. Рациональная Фармакотерапия в Кардиологии. 2025;21(2):132-142. https://doi.org/10.20996/1819-6446-2025-3177. EDN: FNKZUC
For citation:
Meshkova M.А., Starodubtseva I.A., Pashkova A.A. Prognostic factors for stent restenosis in patients with coronary artery disease undergoing percutaneous coronary intervention. Rational Pharmacotherapy in Cardiology. 2025;21(2):132-142. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3177. EDN: FNKZUC
JATS XML
















































