Перейти к:
Профиль биомаркеров и краткосрочный прогноз кардиоренометаболического фенотипа хронической сердечной недостаточности с сохраненной фракцией выброса
https://doi.org/10.20996/1819-6446-2025-3184
EDN: FGCVZU
Аннотация
Цель. Изучить биомаркерный профиль, клинические и эхокардиографические характеристики пациентов кардиоренометаболического фенотипа хронической сердечной недостаточности с сохраненной фракцией выброса (ХСНсФВ), их влияние на полугодовой прогноз.
Материал и методы. Проведено проспективное исследование 80 пациентов кардиоренометаболического профиля ХСНсФВ. Проанализированы анамнез, клинико-демографические данные, сопутствующая патология, выполнен иммуноферментный анализ сыворотки крови для определения концентраций N-концевого промозгового натрийуретического пептида (NT-proBNP), галектина-3, растворимой формы супрессора туморогенности 2 (sST2), фактора, индуцируемого гипоксией 1-альфа (HIF-1α), карбоксиметиллизина (CML), проведены тест с шестиминутной ходьбой и эхокардиографическое исследование с оценкой диастолической функции левого желудочка.
Результаты. Средний уровень NT-proBNP составил 125,8 [109,4; 146,9] пг/мл, галектина-3 — 1,2 [0,9; 1,4] нг/мл, sST2 — 1,5 [0,4; 3,8] нг/мл, HIF-1α — 0,13±0,049 нг/мл, CML — 346,69±50,63 пг/мл. В течение шести месяцев повторно по любой причине госпитализированы 36,3% пациентов, 18,8% из них — по поводу сердечно-сосудистых заболеваний. Методами ROC-анализа и бинарной логистической регрессии выявлены клинические, лабораторные и инструментальные предикторы ранней регоспитализации по сердечно-сосудистой причине: факт такой госпитализации в предшествующие 6 мес., увеличение конечного диастолического размера левого желудочка >5,05 см, систолического давления в легочной артерии >24,5 мм рт.ст., >6,5 баллов по шкале H2FPEF, снижение уровня скорости клубочковой фильтрации <36,97 мл/мин/1,73 м2, индекс коморбидности Чарлсон >5,5 баллов, уровень галектина-3 <1,5 нг/мл. На основании полученных данных разработана модель прогнозирования повторной госпитализации в течение 6 мес. наблюдения, чувствительность которой составила 66,7%, специфичность — 89,1%.
Заключение. Предикторами ранней повторной госпитализации пациентов кардиоренометаболического фенотипа ХСНсФВ являются факт госпитализации по сердечно-сосудистой причине в предшествующие 6 мес., увеличение конечного диастолического размера левого желудочка, систолического давления в легочной артерии, снижение скорости клубочковой фильтрации, индекс коморбидности Чарлсон, уровень галектина-3 и средний балл по шкале H2FPEF.
Ключевые слова
Для цитирования:
Пономарева О.В., Смирнова Е.А., Никифоров А.А., Никифорова Л.В. Профиль биомаркеров и краткосрочный прогноз кардиоренометаболического фенотипа хронической сердечной недостаточности с сохраненной фракцией выброса. Рациональная Фармакотерапия в Кардиологии. 2025;21(4):362-371. https://doi.org/10.20996/1819-6446-2025-3184. EDN: FGCVZU
For citation:
Ponomareva O.V., Smirnova E.A., Nikiforov A.A., Nikiforova L.V. Biomarker profile and short-term prognosis of “cardio-reno-metabolic phenotype” in chronic heart failure with preserved ejection fraction. Rational Pharmacotherapy in Cardiology. 2025;21(4):362-371. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3184. EDN: FGCVZU
Введение
Согласно данным исследования ПРИОРИТЕТ, хроническая сердечная недостаточность (СН) с сохраненной фракцией выброса (ХСНсФВ) является превалирующим фенотипом в нашей стране, а основными сопутствующими некардиальными заболеваниями выступают хроническая болезнь почек (ХБП) (43,2%), ожирение (37,8%) и сахарный диабет (СД) (26,7%) [1]. Американская кардиологическая ассоциация выделяет проблему сочетанного влияния ХБП, нарушений углеводного обмена, артериальной гипертонии, ожирения в самостоятельное понятие «кардиоренометаболического» синдрома. Одной из финальных точек развития данного патологического каскада является СН, и в настоящее время активно обсуждается отдельный фенотип таких больных с СН [2]. Почти 70% пациентов с ХСНсФВ страдают от избыточного веса, СД, дислипидемии, ухудшения функции почек и имеют артериальную гипертонию (АГ), ишемическую болезнь сердца (ИБС), фибрилляцию предсердий (ФП). Показано, что лица с ожирением, СД, дислипидемией, ИБС, ХБП и СН имеют высокую смертность и повышенную частоту повторных госпитализаций [3][4]. С учетом небольшого количества исследований, посвященных кардиоренометаболическому синдрому у пациентов с СН, существует необходимость изучения исходов у данной категории больных, а также выявления оптимальных биомаркеров, имеющих диагностический и прогностический потенциал [5]. Для более подробного изучения авторами данной работы выбраны 5 биомаркеров. Во-первых, N-концевой промозговой натрийуретический пептид (NT-proBNP), как «золотой стандарт» в диагностике СН. Галектин-3, в свою очередь, является сигнальной молекулой, передающей паракринный сигнал фибробластам и, таким образом, запускающей процессы пролиферации фибробластов и депозицию проколлагена [6]. Растворимая форма супрессора туморогенности 2 (sST2) связывает интерлейкин-33 и блокирует эффекты кардиопротективного комплекса: способствует фиброзу, ремоделированию и воспалительной инфильтрации миокарда. Во многих исследованиях sST2 показан как независимый прогностический фактор неблагоприятного прогноза при ХСН [7]. Также пациент с ХСНсФВ подвержен влиянию гипоксии, запускающей фиброз миокарда и диастолическую дисфункцию (особенно в случае курения, ожирения, ХБП). Фактор, индуцируемый гипоксией 1α (HIF-1α) способствует адаптации тканей к ней, но в условиях нарушенной метаболической гибкости его высокий уровень предполагает избыточный воспалительный ответ со стороны клеток иммунной системы и может рассматриваться как фактор миокардиального фиброза [8][9]. Конечные продукты гликирования, основным из которых является карбоксиметиллизин (CML), были предложены в качестве факторов, влияющих на СН и связанных с тяжестью и прогнозом заболевания. CML можно обнаружить в продуктах питания, особенно жареных и приготовленных на гриле, его образование ускоряется при гиподинамии, курении, употреблении высокоуглеводной и высококалорийной пищи [10].
Цель исследования — изучить профиль биомаркеров, выявить клинические и инструментальные предикторы неблагоприятного полугодового прогноза у пациентов кардиоренометаболического фенотипа ХСНсФВ.
Материал и методы
Исследование одобрено локальным этическим комитетом ФГБОУ ВО РязГМУ 13.09.2023 г. За период с 01.10.2023 по 31.05.2024 включено 80 человек: 40 амбулаторных и 40 пациентов, госпитализированных в отделение неотложной кардиологии ГБУ РО ГКБ. Все пациенты подписали добровольное информированное согласие на участие в исследовании.
Критерии включения: возраст старше 18 лет на момент регистрации данных, наличие избыточной массы тела или ожирения, нарушений углеводного обмена, ХБП, ранее установленный диагноз ХСНсФВ в амбулаторной карте (ф. 025/у) или медицинской карте стационарного больного (ф. 003/у).
Критерии невключения: отсутствие подписанной формы добровольного информированного согласия; наличие тяжелых пороков сердца, ХБП С5, хирургического вмешательства давностью <6 мес., онкологических заболеваний вне ремиссии, системных заболеваний соединительной ткани, алкогольной и наркотической зависимости, психических заболеваний, беременности, острых и хронических инфекционных заболеваний.
Обследование и лечение пациентов выполнялось в соответствии с действовавшими клиническими рекомендациями по ХСН 2020 г. [11]. Все госпитализированные больные имели признаки декомпенсации ХСН на фоне ухудшения течения основного заболевания: пароксизма фибрилляции/трепетания предсердий/наджелудочковой тахикардии (45,0%), неконтролируемой АГ (20,0%), стабильной стенокардии напряжения III функционального класса (ФК) (20,0%); у 15,0% пациентов декомпенсация ХСН была связана с несоблюдением рекомендаций врача, пропуском приема препаратов. Все больные в стационаре получали диуретики внутрь, 42,5% пациентов потребовалось внутривенное введение петлевых диуретиков. Амбулаторная группа (группа I) отобрана согласно критериям включения, при активном вызове в рамках диспансерного наблюдения пациентов с ХСН. Взятие крови для определения биомаркеров у подгруппы пациентов, проходивших лечение в стационаре (группа II), осуществлялся после устранения симптомов декомпенсации СН (на 9,04±1,9 сутки), у амбулаторных пациентов — в день обращения. Проведен иммуноферментный анализ сыворотки крови (тест-система от Cloud-Clone Corp., КНР) для определения уровней NT-proBNP (диапазон определения 39-2500 пг/мл, минимальная определяемая концентрация 17 пг/мл, галектина-3 (диапазон определения 0,156-10 нг/мл, минимальная определяемая концентрация 0,054 нг/мл), sST2 (диапазон определения 0,31-20 нг/мл, минимальная определяемая концентрация 0,19 нг/мл), HIF-1α (диапазон определения 0,156-10 нг/мл, минимальная определяемая концентрация 0,061 нг/мл), CML (диапазон определения 61,7-5000 нг/мл, минимальная определяемая концентрация 25,9 нг/мл). Выполнялся подсчет количества баллов по шкалам для верификации ХСНсФВ — шкале H2FPEF и HFA-PEFF. Индекс коморбидности рассчитывался по методике Чарлсон, оценка качества жизни проводилась с использованием Европейского опросника качества жизни (EQ-5D-5L, EuroQol Five-Dimensional Five-Level Questionnaire) и Канзасского опросника для пациентов с кардиомиопатией (KCCQ, Kansas City Cardiomyopathy Questionnaire). Дальнейшее наблюдение через 6 мес. осуществлялось путем телефонного контакта с пациентом/его родственниками, уточнялись витальный статус, причины повторных госпитализаций, ФК ХСН, динамика фракции выброса левого желудочка (ФВ ЛЖ).
Статистический анализ данных проводился с помощью программного обеспечения «SPSS» (IBM Company, США). Проверка распределения количественных данных выполнялась с использованием критерия Колмогорова–Смирнова. Количественные данные при ненормальном распределении представлены в виде медианы и межквартильного размаха (Me [Q25; Q75]), показатели с нормальным распределением описаны в формате (М±SD), сравнение в двух независимых выборках проводилось с применением критерия Манна–Уитни. Для анализа «до/после» количественных переменных использовался критерий Вилкоксона. Качественные переменные представлены в виде абсолютных и относительных величин, значимость различий между ними оценивалась при помощи критерия Хи-квадрат (χ2), в дополнение с двусторонним точным тестом Фишера. Корреляционный анализ выполнен с использованием тестов Спирмена, Фи (φ), V Крамера. Для получения прогностической модели и выявления пороговых уровней исследуемых показателей применялся ROC-анализ и метод бинарной логистической регрессии. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты
Средний возраст пациентов составил 70 [65; 74] лет, превалировали женщины (68,8% vs 31,3%, p<0,05). Курение в анамнезе зарегистрировано у 32,5%, 15,0% являлись курильщиками на момент включения. Средние значения индекса массы тела (ИМТ) составили 32,8 кг/м2 [31,2; 36,5], окружности талии — 104 см [98; 114], теста с шестиминутной ходьбой — 311 м [270; 385]. ХСН I стадии (по Стражеско-Василенко) установлена у 6,3% больных, IIА — у 83,7%, IIБ — у 10,0%. ФК I имели 6,3% исследуемых, ФК II — 70,0%, ФК III — 22,4%, ФК IV — 1,3%, причем ФК II чаще встречался в амбулаторной группе (85,0%), а ФК III среди госпитализированных больных — 35,0% (p<0,05). Пациенты в стационаре имели более высокий балл по шкале оценки клинического состояния (6 [5; 7] vs 5 [4; 6], p<0,05). Клиническая характеристика пациентов с кардиометаболическим фенотипом ХСНсФВ представлена в табл. 1. Амбулаторные пациенты имели большее значение индекса Чарлсон по сравнению с госпитализированными (7 [6; 8] vs 6 [5; 7], p<0,05). Частота сопутствующей патологии среди включенных пациентов представлена на рис. 1.
Таблица 1. Клинико-инструментальная характеристика пациентов кардиоренометаболического фенотипа ХСНсФВ
Симптом/признак | Амбулаторные пациенты, n (٪) | Госпитализированные пациенты, n (٪) | p-value |
Одышка при нагрузке | 37 (92,5) | 30 (75,0) | 0,034 |
Одышка в покое | 3 (7,5) | 11 (27,5) | 0,019 |
Ощущение нехватки воздуха | 1 (2,5) | 4 (10,0) | 0,166 |
Общая слабость | 31 (77,5) | 19 (47,5) | 0,01 |
Повышенная утомляемость | 19 (47,5) | 11 (27,5) | 0,105 |
Сердцебиение | 14 (35,0) | 11 (27,5) | 0,63 |
Перебои в работе сердца | 8 (20,0) | 18 (45,0) | 0,017 |
Дискомфорт за грудиной | 14 (35,0) | 21 (52,5) | 0,115 |
Периферические отеки | 9 (22,5) | 17 (42,5) | 0,056 |
Систолическое АД, мм рт.ст. | 120 [118; 140] | 140 [120,7; 158,2] | 0,007 |
Диастолическое АД, мм рт.ст. | 80 [70; 80] | 80 [80; 90] | 0,005 |
Влажные хрипы в легких | 0 (0,0) | 2 (5,0) | 0,571 |
Сухие хрипы | 5 (12,5) | 4 (10,0) | 0,571 |
Отек легких | 0 (0,0) | 1 (2,5) | 0,314 |
Гидроторакс | 0 (0,0) | 3 (7,5) | 0,241 |
Гидроперикард | 0 (0,0) | 1 (2,5) | 0,314 |
Индекс массы тела, кг/м2 | 32,8 [31,4; 35,2] | 32,85 [31,2; 37,1] | 0,422 |
СКФ, мл/мин/1,73м2 | 53,2 [48,7; 58,7] | 49,4 [41,6; 59,6] | 0,228 |
Фракция выброса левого желудочка, % | 62 [57; 65] | 60 [55; 64] | 0,481 |
Индекс массы миокарда левого желудочка, г/м2 | 128,5±22,5 | 130,5±16,8 | 0,686 |
Относительная толщина стенки левого желудочка | 0,47 [0,43; 0,5] | 0,46 [0,42; 0,5] | 0,733 |
Индексированный объем левого предсердия, мл/м2 | 39,4±8,7 | 41,7±9,4 | 0,333 |
Е/е’ | 9,8 [8; 11] | 9 [7,5; 11,1] | 0,476 |
СДЛА, мм рт.ст. | 28 [23; 34] | 29,5 [24; 36,5] | 0,343 |
Дистанция в тесте с шестиминутной ходьбой, м | 315,5 [291,3; 389,8] | 299 [249; 376] | 0,134 |
Балл по шкале H2FPEF | 6 [5; 6,75] | 6 [5; 7] | 0,262 |
Балл по шкале HFA-PEFF | 4 [4; 5] | 4 [4; 5] | 0,899 |
Общий балл по опроснику KCCQ | 66,6 [60,1; 73,2] | 61,61 [51,51; 67,67] | 0,004 |
Оценка качества жизни по ВАШ (опросник EQ-5D-5L), % | 70 [56; 80] | 50 [40; 70] | 0,002 |
АД — артериальное давление, ВАШ — визуально-аналоговая шкала, СДЛА — систолическое давление в легочной артерии, СКФ — скорость клубочковой фильтрации, Е/e’ — отношение пиковой скорости трансмитрального потока в раннюю диастолу к пиковой скорости движения митрального кольца в раннюю диастолу, EQ-5D-5L — Европейский опросник качества жизни, KCCQ — Канзасский опросник для пациентов с кардиомиопатией | |||
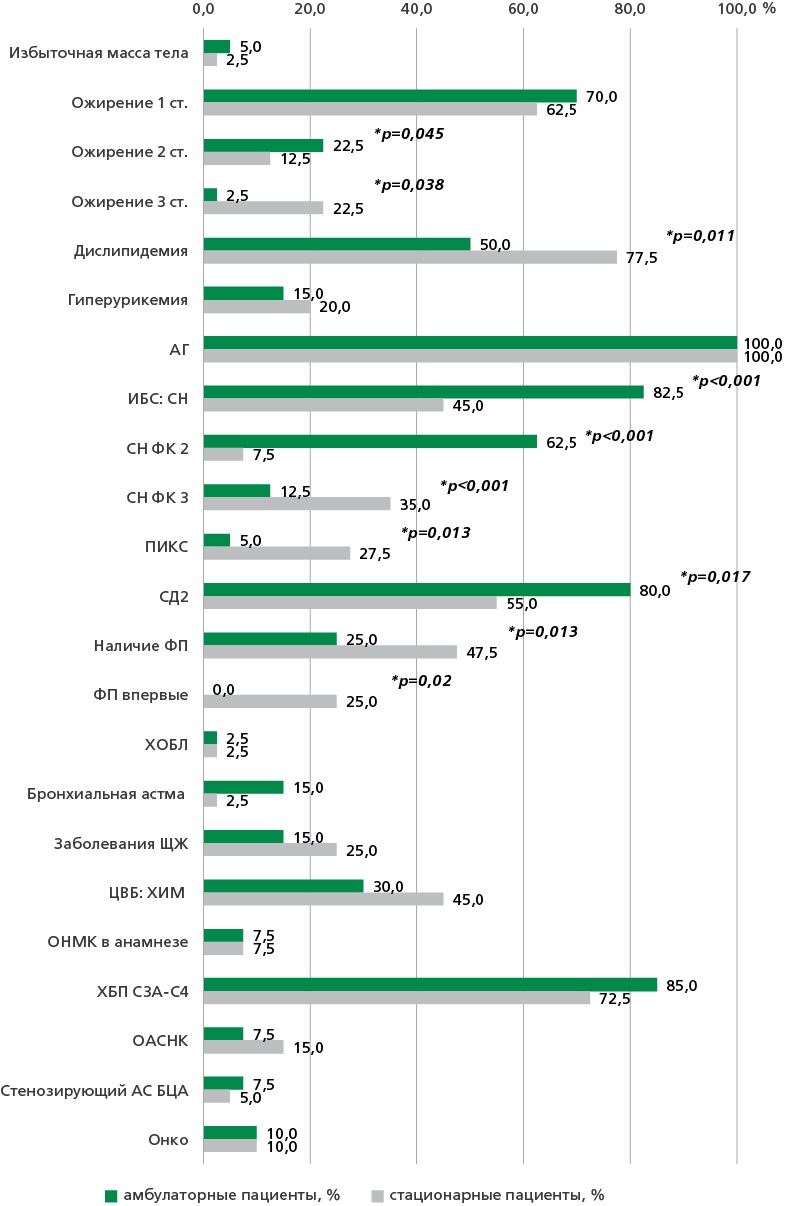
АГ — артериальная гипертензия, АС — атеросклероз, БЦА — брахиоцефальные артерии, ОАСНК — облитерирующий атеросклероз артерий нижних конечностей, онко — онкологические заболевания, ОНМК — острое нарушение мозгового кровообращения, ПИКС — постинфарктный кардиосклероз, СН — стенокардия напряжения, ХБП — хроническая болезнь почек, ХОБЛ — хроническая обструктивная болезнь легких, ЦВБ: ХИМ — цереброваскулярная болезнь: хроническая ишемия мозга, ЩЖ — щитовидная железа
Рисунок 1. Структура коморбидности у пациентов кардиоренометаболического фенотипа ХСНсФВ.
Амбулаторные пациенты отличались меньшим уровнем NT-proBNP, выполненным до включения в исследование с целью верификации диагноза ХСН, по сравнению с госпитализированными пациентами (127,9 пг/мл [67,7; 275,1] vs 349 пг/мл [212,7; 1144,7], p<0,05). Средние значения изучаемых биомаркеров составили: NT-proBNP — 125,8 пг/мл [109,4; 146,9], sST2 — 1,5 нг/мл [0,4; 3,8], HIF-1a — 0,13±0,049 нг/мл, галектин-3 — 1,2 [0,9; 1,4] нг/мл, CML — 346,69±50,63 пг/мл. Значимых различий в показателях между амбулаторными и госпитализированными пациентами не выявлено. Биомаркерный профиль больных представлен на рис. 2.
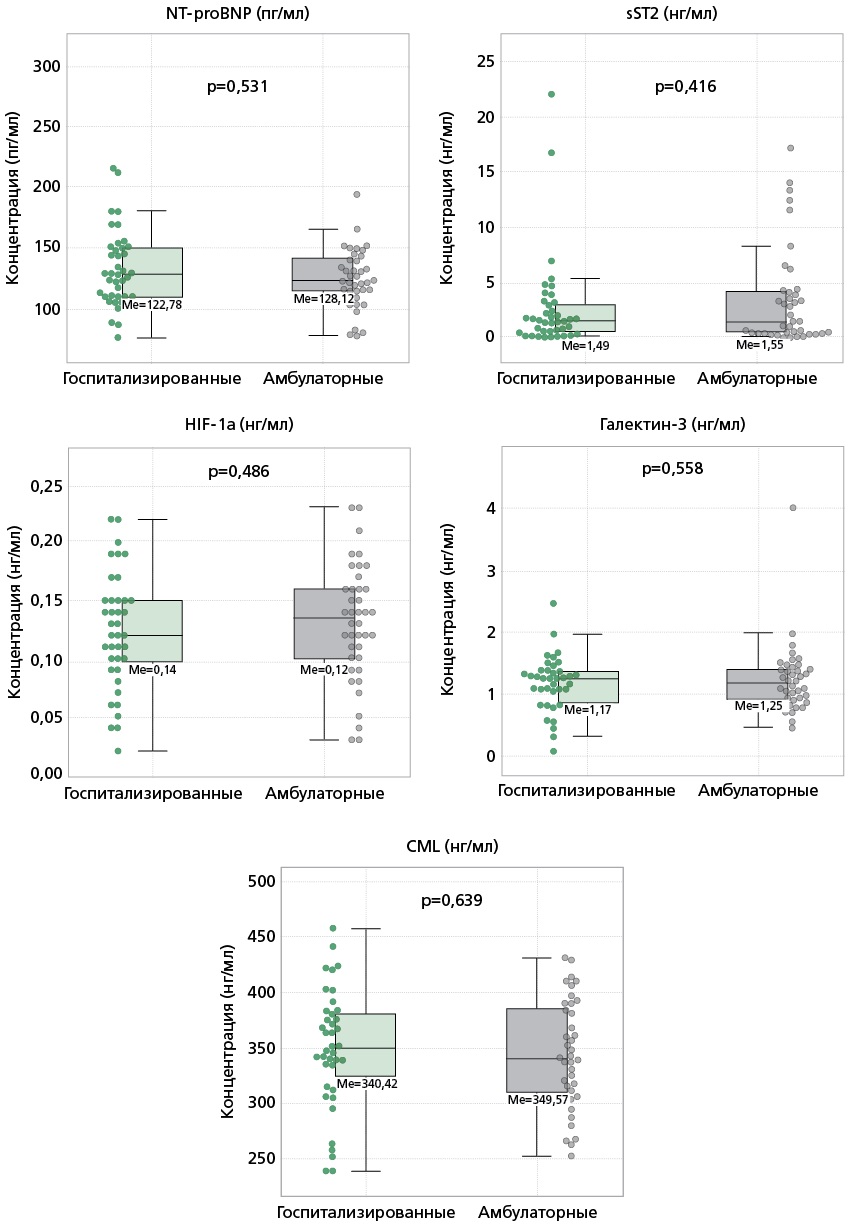
CML — карбоксиметиллизин, HIF-1α — фактор индуцируемый гипоксией 1α, Ме — медиана, NT-proBNP — N-концевой промозговой натрийуретический пептид, sST2 — растворимая форма супрессора туморогенности 2
Рисунок 2. Биомаркерный профиль у амбулаторных и стационарных пациентов кардиоренометаболического фенотипа ХСНсФВ.
При анализе эхокардиограмм установлено, что медиана ФВ ЛЖ — 61,5% [55; 64].Средний индексированный объем левого предсердия составил 40,4±9,05 мл/м2, конечный диастолический размер (КДР) ЛЖ — 5,2 см [4,9; 5,5], конечный систолический размер ЛЖ 3,5 см [3,2; 3,9], конечный диастолический объем ЛЖ — 124 мл [112; 141], конечный систолический объем ЛЖ — 47 мл [42; 57], индекс массы миокарда ЛЖ — 129,4±20,1 г/м2, относительная толщина стенки ЛЖ — 0,46 мм [0,42; 0,5], E/e’ — 9,2 [7,6; 11], систолическое давление в легочной артерии (СДЛА) 29 мм рт.ст. [23,2; 35] Также был рассчитан индекс глобальной функции ЛЖ — 22,6% [18,3; 25,5] [12].
Через 6 мес. скончался 1 пациент по причине повторного ишемического инсульта, 22,5% потребовалось усиление диуретической терапии, распределение по ФК значимо не изменилось (ФК 1 ХСН имели 6,5% пациентов, ФК II — 77,5%, ФК III — 10,0%). Госпитализированы по любой причине — 36,3%, по причине сердечно-сосудистых заболеваний — 18,8%, большинство из которых — включенные в исследование в стационаре (27,5% vs 5,0%, p<0,001). Медиана ФВ ЛЖ снизилась за 6 мес. до 60% [50; 64] (p<0,05), средний показатель ФВ ЛЖ был значимо выше в подгруппе амбулаторных пациентов (63 % [58; 65] vs 52 % [45,7; 59], p<0,05).
Выявлена статистически значимая связь предшествующего стационарного лечения с повторной госпитализацией через 6 мес. (φ, V Крамера = 0,593, p<0,001). Повышение уровня галектина-3 коррелировало со снижением скорости клубочковой фильтрации (СКФ) у пациентов (r=-0,247, p<0,05). Обнаружено влияние повышения уровня sST2 на усугубление ФК ХСН через 6 мес. (прямая связь, умеренной силы, φ, V Крамера = 0,348, p<0,05). Также выявлена прямая связь средней силы между стадией ХБП и ФК ХСН через 6 мес. (φ, V Крамера = 0,348, p<0,05).
При проведении ROC-анализа выявлены предикторы сердечно-сосудистой регоспитализации (рис. 3). Е/е’ показал эффективность в прогнозировании госпитализации через 6 мес. по любой причине. Площадь под ROC-кривой (AUC) составила 0,68±0,074 с 95% доверительным интервалом (ДИ): 0,533-0,823; p=0,028. Пороговое значение Е/е’ в точке cut-off равно 8,75. Чувствительность и специфичность — 76,2% и 52,9%, соответственно. Обнаружена взаимосвязь повторной сердечно-сосудистой госпитализации через 6 мес. и уровня КДР (AUC = 0,814±0,08 с 95% ДИ: 0,658-0,97; p=0,005). КДР в точке cut-off равно 5,05 см. Чувствительность и специфичность — 78,6% и 64,3%, соответственно. Выявлена взаимосвязь вышеописанного исхода через 6 мес. и уровня СДЛА (AUC = 0,847±0,071 с 95% ДИ: 0,707-0,987; p=0,002). СДЛА в точке cut-off = 24,5 мм рт.ст. Чувствительность и специфичность — 92,9% и 57,1%. Влияние предшествующего в течение 6 мес. стационарного лечения на раннюю регоспитализацию подтвердилось ROC-анализом (AUC = 0,644±0,077 с 95% ДИ: 0,493-0,794; p=0,008).
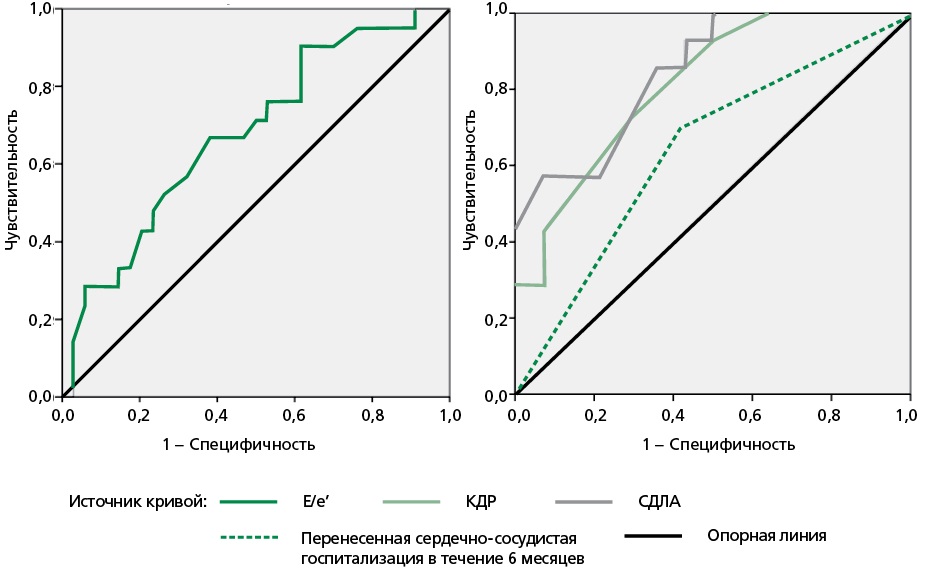
КДР — конечный диастолический размер, СДЛА — систолическое давление в легочной артерии, E/e’ — отношение пиковой скорости трансмитрального потока в раннюю диастолу к пиковой скорости движения митрального кольца в раннюю диастолу
Рисунок 3. Предикторы ранней регоспитализации у пациентов кардиоренометаболического профиля ХСНсФВ по данным ROC-анализа.
Для построения прогностической модели поиск предикторов проводился среди факторов, показавших различия между амбулаторными и госпитализированными пациентами. Наблюдаемая зависимость описывается уравнением:
P = 1 / (1 + e–z ) × 100%
z = 8,909 + (-2,406)XГалектин-3 + (-0,111)XСКФ +
+ (-0,996)XИндекс Чарлсон + 0,747XH2FPEF ,
где P — вероятность наступления ранней сердечно-сосудистой регоспитализации, XГалектин-3 — уровень галектина-3 (нг/мл), XСКФ — значение СКФ
(мл/мин/1,73 м2), XИндекс Чарлсон — индекс коморбидности Чарлсон в баллах, XH2FPEF — количество баллов по шкале H2FPEF.
Полученная модель является статистически значимой, p<0,001. Согласно коэффициенту детерминации Найджелкерка, она учитывает 51,8% факторов, определяющих возможность ранней сердечно-сосудистой регоспитализации. При использовании ранговой корреляции Спирмена установлена статистически значимая прямая связь заметной силы (ρ=0,514; p<0,001) между ожидаемыми и наблюдаемыми значениями. Чувствительность = 66,7%, специфичность = 89,1%. Графическое изображение этих данных представлено на рис. 4. Оптимальными пороговыми значениями, с наибольшей чувствительностью прогнозирующими риск неблагоприятного исхода, являются: H2FPEF = 6,5 баллов, индекс Чарлсон = 5,5 баллов, СКФ = 36,97 мл/мин/1,73 м2, галектин-3 = 1,5 нг/мл.
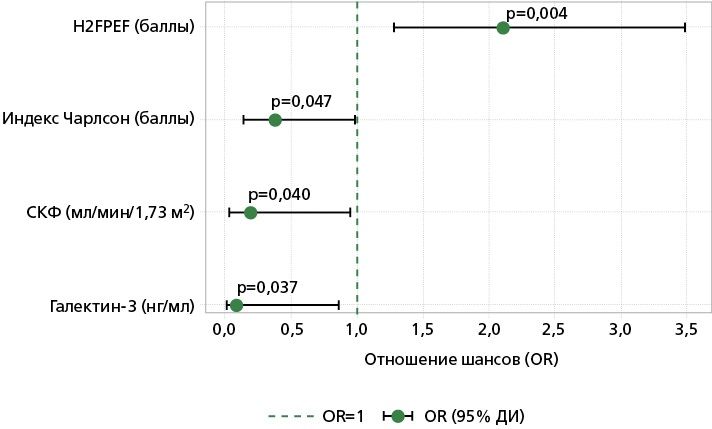
ДИ — доверительный интервал, СКФ — скорость клубочковой фильтрации, H2FPEF — количество баллов по шкале H2FPEF, OR — odds ratio (отношение шансов)
Рисунок 4. Предикторы регоспитализации в течение 6 мес. по сердечно-сосудистой причине для пациентов кардиоренометаболического фенотипа ХСНсФВ.
Обсуждение
ХСНсФВ, в частности кардиоренометаболический фенотип, является многогранным процессом, включающим в себя множество патогенетических факторов, комплексно действующих на больного [13]. ХСНсФВ сложно однозначно диагностировать лабораторными методами. NT-proBNP — наиболее изученный биомаркер, проявляющий при этом широкую вариабельность диагностических пороговых значений в зависимости от пола, возраста, ритма сердца (синусовый или фибрилляция предсердий), наличия ожирения, острой декомпенсации СН, ХБП [14]. Все больше данных свидетельствует о том, что это не идеальный маркер ХСНсФВ. Существует много внешних факторов, изменяющих его пороговый уровень (<125 пг/мл), при том, что у больных регистрируются признаки застоя в лёгких, ремоделирования сердца и три четверти пациентов с ХСНсФВ нуждаются в применении диуретиков [15]. Показано, что у симптомных пациентов с уровнем NT-proBNP <125 пг/мл наблюдалось ухудшение глобальной продольной деформации ЛЖ за 3 года наблюдения. У здоровых людей из контрольной группы такого прогрессирования не обнаружено. Кроме того, женский пол, ожирение, возраст <75 лет, анемия, длительный прием валсартана+сакубитрила, перенесенный инфаркт миокарда могут снижать значение NT-proBNP. Такие пациенты имеют схожую выраженность симптомов и снижение качества жизни по данным опросников, как и больные с высокими показателями [15, 16]. Таким образом, невысокие значения NT-proBNP у пациентов в возрасте до 75 лет, страдающих ожирением, следует рассматривать не как критерий исключения ХСН, а, напротив, как повод для настороженности в отношении возможного неблагоприятного прогноза.
Галектин-3 во многих исследованиях показал значимую связь с диагнозом ХСНсФВ. Крупное обсервационное исследование Diast-CHF включило 1386 человек с ФВ ЛЖ ≥50% и хотя бы 1 фактор риска развития ХСНсФВ (наличие АГ, СД, апноэ во сне, атеросклероза периферических артерий, перенесенного инфаркта/инсульта). За время 10-летнего наблюдения установлено, что уровень галектина-3 более 13,57 нг/мл предсказывал развитие ХСНсФВ, смертность от всех причин и сердечно-сосудистых госпитализаций, независимо от NT-proBNP [17]. B. M. Baccouche и соавт. продемонстрировали пользу галектина-3 в верификации ХСНсФВ, выявив значимую разницу в его уровнях по сравнению с контрольной группой, обнаружили положительную корреляцию между повышенным уровнем галектина-3 и степенью диастолической дисфункции, фиброза миокарда, показали, что галектин-3 является независимым прогностическим фактором не только повторной госпитализации при ХСНсФВ, но и общей смертности [18]. При этом, имеются работы, в которых более низкие уровни галектина-3 имеют значение у пациентов с диастолической дисфункцией ЛЖ, ХСНсФВ и метаболическими нарушениями. В исследовании А. А. Снетковой и соавт. средний уровень этого биомаркера у больных с СД и ХСНсФВ составил 0,92 нг/мл [0,89; 1,01] [19]. В представленной работе низкие значения галектина-3 явились предиктором ранней сердечно-сосудистой регоспитализации. С одной стороны, низкие показатели галектина-3 могут быть связаны с применением тест-систем другого производителя, так как согласно инструкции, максимальная определяемая концентрация составляет 10 нг/мл, с другой стороны, на его уровень могла повлиять медикаментозная терапия ХСН и сопутствующих заболеваний. Известно, что важным стимулятором экспрессии этой молекулы является альдостерон, поэтому необходимо учитывать влияние терапии антагонистами альдостерона, ингибиторами ангиотензинпревращающего фермента, блокаторами рецепторов ангиотензина II [17].
В научных работах по изучению sST2 при ХСНсФВ получены самые разные уровни этого показателя — от 0,26 нг/мл до 67,9 нг/мл, данные о его клинической пользе противоречивы. В работе В. И. Подзолкова и соавт. предиктором неблагоприятного прогноза (смерти по любой причине) у пациентов с ХСН с ФВ ЛЖ >40% явилось пороговое значение sST2 >27,1 нг/мл [20]. Применение логарифмического масштабирования позволяет сгладить эти различия. Выявлено, что при динамическом повышении sST2 на единицу логарифмического увеличения (ln, е ≈ 2,72), в 6,52 раза увеличивался риск комбинированной конечной точки смерти от всех причин и госпитализации по поводу декомпенсации СН [21].
Повышенный уровень CML ассоциирован с более тяжелым функциональным классом ХСН и является независимым предиктором увеличения смертности у пациентов как с ХСНсФВ, так и с ХСН с низкой ФВ ЛЖ [22]. HIF-1α и CML — это новые молекулы, не имеющие четких референсных значений и требующие дальнейшего изучения их роли в патогенезе ХСН и влиянии на прогноз больных.
Эхокардиографические параметры демонстрируют важные гемодинамические изменения.Увеличение КДР указывает на дилатацию ЛЖ, связанную с перегрузкой объемом или давлением, является признаком прогрессирующего ремоделирования сердца, ухудшает его функцию, увеличивает риск осложнений. Повышение СДЛА свидетельствует об увеличении нагрузки на правый желудочек, может привести к его дисфункции и дальнейшему ухудшению прогноза. Установлено, что высокое СДЛА связано с повышенным риском госпитализаций и смертности у пациентов с ХСНсФВ [23].
В основе ХСНсФВ и ХБП лежат схожие патофизиологические механизмы, такие как чрезмерная активация ренин-ангиотензин-альдостероновой и симпатической нервной систем, а также повышенный окислительный стресс, что способствует увеличению жёсткости сосудов и может вызывать гипертрофию ЛЖ, фиброз миокарда и диастолическую дисфункцию [24]. Проведенное исследование подтверждает данный факт, демонстрируя отрицательное влияние снижения ренальной функции на краткосрочный прогноз пациента.
Таким образом, получена модель прогнозирования ранней сердечно-сосудистой регоспитализации у пациентов кардиоренометаболического профиля ХСНсФВ. Следует отметить, что J. Hu и соавт. была разработана прогностическая номограмма для оценки риска 30-дневной повторной госпитализации у пациентов с сердечной недостаточностью. С использованием LASSO-регрессии были выделены 13 независимых предикторов, включая возраст, пол, уровень цистатина С, альбумина, ширины распределения эритроцитов, нейтрофилов, NT-proBNP, высокочувствительного тропонина Т, миоглобина, ФВ ЛЖ, КДР, а также наличие дислипидемии, фибрилляции предсердий. Построенная модель продемонстрировала удовлетворительные характеристики (AUC = 0,653; 95% ДИ: 0,608-0,698) [25]. Полученная в представленном исследовании модель уникальна именно для применения среди пациентов кардиоренометаболического профиля ХСНсФВ и удобна для практического врача — формула включает в себя всего 4 показателя, при этом охватывает клинические, лабораторные аспекты, а также ЭхоКГ-параметры через призму шкалы H2FPEF. Использование данного прогностического инструмента позволит легко выявлять пациентов высокого риска раннего неблагоприятного исхода в реальной клинической практике.
Ограничения исследования
Ограничениями исследования являются малая выборка пациентов, короткое время наблюдения, отсутствие контрольной группы здоровых добровольцев и анализа медикаментозной терапии.
Заключение
Обнаружен значимый вклад факта сердечно-сосудистой госпитализации, показателей КДР, СДЛА, H2FPEF-баллов, СКФ и галектина-3 в прогнозировании неблагоприятных краткосрочных исходов у больных кардиоренометаболического фенотипа ХСНсФВ. Учитывая вышеперечисленные ограничения, очерчиваются перспективы для дальнейшего исследования в этой области.
Список литературы
1. Шляхто Е.В., Беленков Ю.Н., Бойцов С.А. и др. Результаты промежуточного анализа проспективного наблюдательного многоцентрового регистрового исследования пациентов с хронической сердечной недостаточностью в Российской Федерации «ПРИОРИТЕТ-ХСН»: исходные характеристики и лечение первых включенных пациентов. Российский кардиологический журнал. 2023;28(10):5593. DOI:10.15829/1560-4071-2023-5593.
2. Ndumele CE, Rangaswami J, Chow SL, et al.; American Heart Association. Cardiovascular-Kidney-Metabolic Health: A Presidential Advisory From the American Heart Association. Circulation. 2023;148(20):1606-35. DOI:10.1161/CIR.0000000000001184.
3. Cohen JB, Schrauben SJ, Zhao L, et al. Clinical Phenogroups in Heart Failure With Preserved Ejection Fraction: Detailed Phenotypes, Prognosis, and Response to Spironolactone. JACC Heart Fail. 2020;8(3):172-84. DOI:10.1016/j.jchf.2019.09.009.
4. Gu J, Pan JA, Lin H, et al. Characteristics, prognosis and treatment response in distinct phenogroups of heart failure with preserved ejection fraction. Int J Cardiol. 2021;323:148-54. DOI:10.1016/j.ijcard.2020.08.065.
5. Chen H, Chhor M, Rayner BS, et al. Evaluation of the diagnostic accuracy of current biomarkers in heart failure with preserved ejection fraction: A systematic review and meta-analysis. Arch Cardiovasc Dis. 2021;114(12):793-804. DOI:10.1016/j.acvd.2021.10.007.
6. McCullough PA, Olobatoke A, Vanhecke TE. Galectin-3: a novel blood test for the evaluation and management of patients with heart failure. Rev Cardiovasc Med. 2011;12(4):200-10. DOI:10.3909/ricm0624.
7. Aimo A, Januzzi JL Jr, Bayes-Genis A, et al. Clinical and Prognostic Significance of sST2 in Heart Failure: JACC Review Topic of the Week. J Am Coll Cardiol. 2019;74(17):2193-203. DOI:10.1016/j.jacc.2019.08.1039.
8. Пономарева О.В., Смирнова Е.А. Современный взгляд на роль фиброза миокарда и его биохимических маркеров в диагностике хронической сердечной недостаточности. Наука молодых (Eruditio Juvenium). 2024;12(2):303-16. DOI:10.23888/HMJ2024122303-316.
9. Калинин Р. Е., Сучков И. А., Райцев С. Н. и др. Роль фактора, индуцируемого гипоксией, 1α при адаптации к гипоксии в патогенезе новой коронавирусной болезни 2019. Российский медико-биологический вестник им. академика И.П. Павлова. 2024;32(1):133-44. DOI:10.17816/PAVLOVJ165536.
10. Khan MI, Ashfaq F, Alsayegh AA, et al. Advanced glycation end product signaling and metabolic complications: Dietary approach. World J Diabetes. 2023;14(7):995-1012. DOI:10.4239/wjd.v14.i7.995.
11. Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4083. DOI:10.15829/1560-4071-2020-4083.
12. Ларина В.Н., Лунев В.И., Алёхин М.Н. Индекс глобальной функции левого желудочка: прогностическое значение у пациентов с хронической сердечной недостаточностью в возрасте 60 лет и старше. Кардиоваскулярная терапия и профилактика. 2020;19(5):2404. DOI:10.15829/1728-8800-2020-2404.
13. Capone F, Sotomayor-Flores C, Bode D, et al. Cardiac metabolism in HFpEF: from fuel to signalling. Cardiovasc Res. 2023;118(18):3556-75. DOI:10.1093/cvr/cvac166.
14. Галявич А.С., Терещенко С.Н., Ускач Т.М. и др. Хроническая сердечная недостаточность. Клинические рекомендации 2024. Российский кардиологический журнал. 2024;29(11):6162. DOI:10.15829/1560-4071-2024-6162.
15. Kondo T, Campbell R, Jhund PS, et al. Low Natriuretic Peptide Levels and Outcomes in Patients With Heart Failure and Preserved Ejection Fraction. JACC Heart Fail. 2024;12(8):1442-55. DOI:10.1016/j.jchf.2024.04.027.
16. Clemente G, Soldano JS, Tuttolomondo A. Heart Failure: Is There an Ideal Biomarker? Rev Cardiovasc Med. 2023;24(11):310. DOI:10.31083/j.rcm2411310.
17. Trippel TD, Mende M, Düngen HD, et al. The diagnostic and prognostic value of galectin-3 in patients at risk for heart failure with preserved ejection fraction: results from the DIAST-CHF study. ESC Heart Fail. 2021;8(2):829-41. DOI:10.1002/ehf2.13174.
18. Baccouche BM, Rhodenhiser E. Galectin-3 and HFpEF: Clarifying an Emerging Relationship. Curr Cardiol Rev. 2023;19(5):19-26. DOI:10.2174/1573403X19666230320165821.
19. Снеткова А.А., Тимофеева Н.Ю., Задионченко В.С. Диагностическая ценность уровня галектина-3 у пациентов с хронической сердечной недостаточностью и сахарным диабетом 2 типа. Рациональная Фармакотерапия в Кардиологии. 2015;11(2):139-43. DOI:10.20996/1819-6446-2015-11-2-139-143.
20. Подзолков В.И., Драгомирецкая Н.А., Толмачева А.В. и др. Прогностическая значимость биомаркеров NT-proBNP и sST2 у пациентов с хронической сердечной недостаточностью с сохраненной и умеренно сниженной фракцией выброса левого желудочка. Рациональная Фармакотерапия в Кардиологии. 2023;19(4):310-9. DOI:10.20996/10.20996/1819-6446-2023-2919.
21. Shi Y, Liu J, Liu C, et al. Diagnostic and prognostic value of serum soluble suppression of tumorigenicity-2 in heart failure with preserved ejection fraction: A systematic review and meta-analysis. Front Cardiovasc Med. 2022;9:937291. DOI:10.3389/fcvm.2022.937291.
22. Hartog JW, Voors AA, Bakker SJ, et al. Advanced glycation end-products (AGEs) and heart failure: pathophysiology and clinical implications. Eur J Heart Fail. 2007;9(12):1146-55. DOI:10.1016/j.ejheart.2007.09.009.
23. Obokata M, Reddy YNV, Borlaug BA. Diastolic Dysfunction and Heart Failure With Preserved Ejection Fraction: Understanding Mechanisms by Using Noninvasive Methods. JACC Cardiovasc Imaging. 2020;13(1 Pt 2):245-57. DOI:10.1016/j.jcmg.2018.12.034
24. Bonacchi G, Rossi VA, Garofalo M, et al. Pathophysiological Link and Treatment Implication of Heart Failure and Preserved Ejection Fraction in Patients with Chronic Kidney Disease. Biomedicines. 2024;12(5):981. DOI:10.3390/biomedicines12050981.
25. Hu J, He Z, Cheng L, et al. A Predictive Model of Early Readmission for Patients with Heart Failure. J Vasc Dis. 2022;1(2):88-96. DOI:10.3390/jvd1020010.
Об авторах
О. В. ПономареваРоссия
Пономарева Ольга Владимировна
Рязань
Е. А. Смирнова
Россия
Смирнова Елена Амишевна
Рязань
А. А. Никифоров
Россия
Никифоров Александр Алексеевич
Рязань
Л. В. Никифорова
Россия
Никифорова Лариса Владимировна
Рязань
Дополнительные файлы
Рецензия
Для цитирования:
Пономарева О.В., Смирнова Е.А., Никифоров А.А., Никифорова Л.В. Профиль биомаркеров и краткосрочный прогноз кардиоренометаболического фенотипа хронической сердечной недостаточности с сохраненной фракцией выброса. Рациональная Фармакотерапия в Кардиологии. 2025;21(4):362-371. https://doi.org/10.20996/1819-6446-2025-3184. EDN: FGCVZU
For citation:
Ponomareva O.V., Smirnova E.A., Nikiforov A.A., Nikiforova L.V. Biomarker profile and short-term prognosis of “cardio-reno-metabolic phenotype” in chronic heart failure with preserved ejection fraction. Rational Pharmacotherapy in Cardiology. 2025;21(4):362-371. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3184. EDN: FGCVZU
JATS XML
















































