Перейти к:
Новые аспекты диагностики синдрома такоцубо
https://doi.org/10.20996/1819-6446-2025-3188
EDN: MOYAUD
Аннотация
В последние годы наблюдается повышенный интерес исследователей к изучению синдрома такоцубо (СТ), представляющего собой особую форму обратимой дисфункции миокарда левого желудочка, а в редких случаях — правого желудочка. Известно, что данная патология преимущественно встречается у женщин в постменопаузе и в большинстве случаев провоцируется перенесенным физическим и/или эмоциональным стрессом. Вместе с тем патофизиология СТ до конца не изучена, в настоящее время ключевое значение отводится всплеску катехоламинов и активации симпатической нервной системы. Ввиду того, что по клинической и электрокардиографической картинам, а также профилю кардиоспецифичных маркеров СТ схож с острым коронарным синдромом, проведение дифференциальной диагностики между этими двумя состояниями является задачей, требующей от врача высокой степени ответственности. Кроме того, несмотря на обратимый характер изменений, наблюдаемых при СТ, заболевание ассоциировано с высоким риском развития как серьезных внутрибольничных, так и отдаленных осложнений. Основным методом визуализации, позволяющим выявить характерную форму акинезии или дискинезии верхушки левого желудочка, а также исключить другие причины острой сердечной недостаточности является эхокардиография. Вместе с тем немаловажное значение в диагностике СТ отводится коронарной ангиографии, при которой ключевым признаком служит отсутствие обструктивного поражения коронарных артерий, и магнитно-резонансной томографии сердца, позволяющей оценить степень отека миокарда, наличие фиброза и другие структурные изменения. Таким образом, использование мультимодального подхода к визуализации существенно повышает надежность постановки диагноза и позволяет своевременно оценить вероятный прогноз у больных с СТ. Цель обзора — представить актуальную информацию об этиологии, клинических особенностях СТ, а также рассмотреть современные представления о диагностике данной патологии.
Ключевые слова
Для цитирования:
Абдужамалова Н.М., Мамедов М.Н. Новые аспекты диагностики синдрома такоцубо. Рациональная Фармакотерапия в Кардиологии. 2025;21(3):289-297. https://doi.org/10.20996/1819-6446-2025-3188. EDN: MOYAUD
For citation:
Abduzhamalova N.M., Mamedov M.N. New aspects in the diagnosis of takotsubo syndrome. Rational Pharmacotherapy in Cardiology. 2025;21(3):289-297. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3188. EDN: MOYAUD
Введение
Синдром такоцубо (СТ), также известный как «синдром разбитого сердца (СРС)» или «стресс-индуцированная кардиомиопатия» (КМП) — острое сердечно-сосудистое состояние, проявляющееся клиническими и параклиническими признаками, напоминающими острый коронарный синдром (ОКС). Характерной особенностью СТ служит внезапная транзиторная дисфункция левого желудочка (ЛЖ), а иногда — правого желудочка (ПЖ), обычно развивающаяся в отсутствие обструктивного поражения коронарного русла [1][2].
В 1990 г. японские кардиологи под руководством Хикару Сато впервые описали серию случаев КМП такоцубо. Ученые выяснили, что в начальные часы болезни вследствие апикальной дилатации и снижения сократительной функции, ЛЖ (в конце систолы) приобретает конфигурацию, схожую с глиняной посудой, используемой для ловли осьминогов — такоцубо («тако» — осьминог, «цубо» — чаша), что и стало основанием для названия данного синдрома [1][2].
Эпидемиология
Распространенность СТ составляет 1-3% среди всех пациентов, поступающих в стационар с клинической картиной ОКС и 5-6% среди пациентов женского пола с подозрением на ОКС [1]. Вместе с тем вследствие гиподиагностики данного состояния (особенно у пациентов, имеющих сопутствующую ишемическую болезнь сердца (ИБС)), не исключено, что в реальной клинической практике встречаемость данной патологии может быть выше. Значительный рост заболеваемости стрессовой КМП наблюдался в период пандемии COVID-19, что, по-видимому, обусловлено как повышенным психологическим дистрессом, так и развивающимся у пациентов цитокиновым штормом [3].
Подавляющее большинство пациентов (около 90%) — это женщины постменопаузального периода, средний возраст которых 65-70 лет (рис. 1). У лиц моложе 50 лет частота встречаемости КМП составляет примерно 10% и эту группу преимущественно представляют мужчины, имеющие сопутствующие неврологические или психические заболевания. Кроме того, следует отметить, что такая категория больных подвержена повышенному риску развития осложнений [1][4]. Так, в работе V. L. Cammann и соавт. пациенты, включенные в международный регистр такоцубо (InterTAK Registry, 2092 пациента с СТ) были стратифицированы по возрасту: ≤50 лет (11,5%), 51-74 года (56,9%) и ≥75 лет (31,6%). Согласно полученным результатам у более молодых пациентов чаще, чем у пациентов среднего и пожилого возраста, развивался кардиогенный шок (15,3%; 9,1% и 8,1%, соответственно, p=0,004), проводилась сердечно-легочная реанимация (11,6%; 5,9% и 3,9%, соответственно; p <0,001) и чаще возникала необходимость использования катехоламинов (23,7%; 11,4% и 9,6%, соответственно; p <0,001). Кроме того, у пациентов более молодого возраста (<50 лет) была выше внутрибольничная смертность (6,6 % vs 3,6% и 5,1%, соответственно; p=0,07) [5]. Аналогичные результаты в отношении внутрибольничных осложнений были получены при анализе базы данных пациентов с СТ национальной выборки стационарных больных США за период 2009-2015 гг. (n=40326) [6], а также по итогам регистра GEIST (German Italian Spanish Takotsubo Registry, n=2492) [7]. Так, в первом исследовании среди пациентов с СТ младше 50 лет чаще наблюдались кардиогенный шок — у 11,9%, желудочковые аритмии — у 6,8%, а остановка сердца — у 3,3% больных, чем в группах среднего (4,8%; 3,2% и 1,1%, соответственно) и пожилого возраста (3,4%, 3,5% и 0,8%, соответственно) [6].

Рисунок 1. Гендерные различия при СТ.
Пусковые факторы и классификация СТ
Общеизвестно, что главным пусковым фактором в развитии СТ служит предшествующее стрессовое событие. Учитывая то, что первые проявления стресс-индуцированной КМП были зафиксированы после землетрясения в Японии, изначально считалось, что провоцирующее событие может иметь только негативный эмоциональный характер [1][8]. Действительно, зачастую СТ вызывают отрицательные эмоциональные реакции (тяжелая утрата, стихийное бедствие и др.), но в 2014 г. группой авторов под руководством D. Qin опубликованы данные, подтверждающие, что положительные эмоции (свадьба, крупные выигрыши и т.д.) тоже могут способствовать развитию СТ и впоследствии такая КМП получила название — «синдром счастливого сердца» (ССС) [9].
В процессе изучения СТ было установлено, что помимо эмоциональных в качестве триггера выступают и физические факторы (рис. 2): соматические заболевания, среди которых лидирующее место занимает патология легких [10][11]; оперативные вмешательства; лекарственные воздействия и др., причем распространенность последних даже выше, чем эмоционального стресса (27,7% и 36,0%, соответственно). На сегодняшний день доказано, что физический фактор чаще наблюдается у мужчин, тогда как эмоциональный — у женщин. Вместе с тем примерно в 8% случаев в основе заболевания лежит сочетание физического и эмоционального триггера, а у одной трети пациентов причина развития КМП такоцубо остается неизвестной [10][11]. К сожалению, несмотря на то, что СТ известен уже более трех десятилетий по-прежнему остаются недостаточно изученными механизмы его развития. На рис. 3 представлены основные теории патогенеза заболевания [2][4][12].

Рисунок 2. Пусковые факторы СТ.
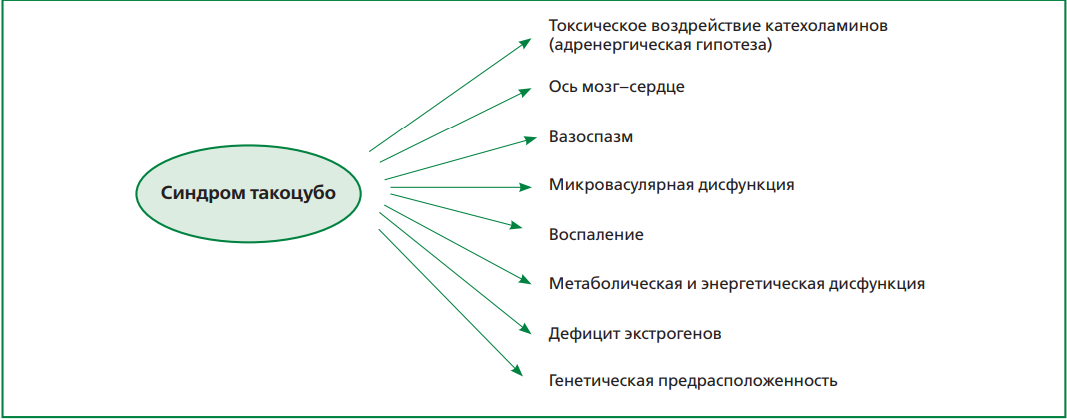
Рисунок 3. Теории патогенеза СТ.
В научной литературе приведены примеры стресс-индуцированной КМП у детей, что указывает на потенциальную роль определенных генетических факторов. Примечательно, что большинство детей с СТ — это подростки мужского пола, часто страдающие психическими расстройствами, преимущественно обусловленные приемом психоактивных веществ. Смертность от СТ у детей составляет порядка 7% [13][14].
Таким образом, учитывая разнообразие факторов, способствующих развитию СТ, было предложено классифицировать его на:
- первичный, при котором пусковым фактором служит эмоциональный стресс;
- вторичный, когда в качестве катализатора выступает физический стресс;
- СТ неустановленной этиологии.
Как правило вторичная форма СТ развивается у пациентов, госпитализированных в стационар по поводу другой патологии. В таких случаях СТ можно рассматривать как осложнение исходного заболевания [15].
Клиническая картина, осложнения
Клинические признаки СТ в большинстве случаев схожи с таковыми при ОКС. Однако, у некоторых пациентов стресс-индуцированная КМП может протекать абсолютно бессимптомно и тогда диагноз устанавливается на основании данных лабораторно-инструментального обследования [1]. Боль в грудной клетке и одышка являются самыми распространенными проявлениями заболевания [7][10]. В то же время СТ может дебютировать симптомами развившихся осложнений (рис. 4), таких как отек легких, кардиогенный шок, угрожающие жизни аритмии, а иногда даже остановкой сердца [1, 16]. Среди серьезных, но относительно редких осложнений выделяются внутрижелудочковый тромбоз (2-8% случаев), который может служить причиной развития инсульта, и разрыв свободной стенки ЛЖ, встречающийся менее чем в 1% случаев [16]. Следует еще раз отметить, что у представителей мужского пола осложнения наблюдаются значительно чаще, чем у женского [17]. Так, в работе L. Arcari и соавт., основанной на анализе данных регистра GEIST, частота развития кардиогенного шока была статистически значимо выше у мужчин, чем у женщин (16% и 6% соответственно; р <0,05) [18].
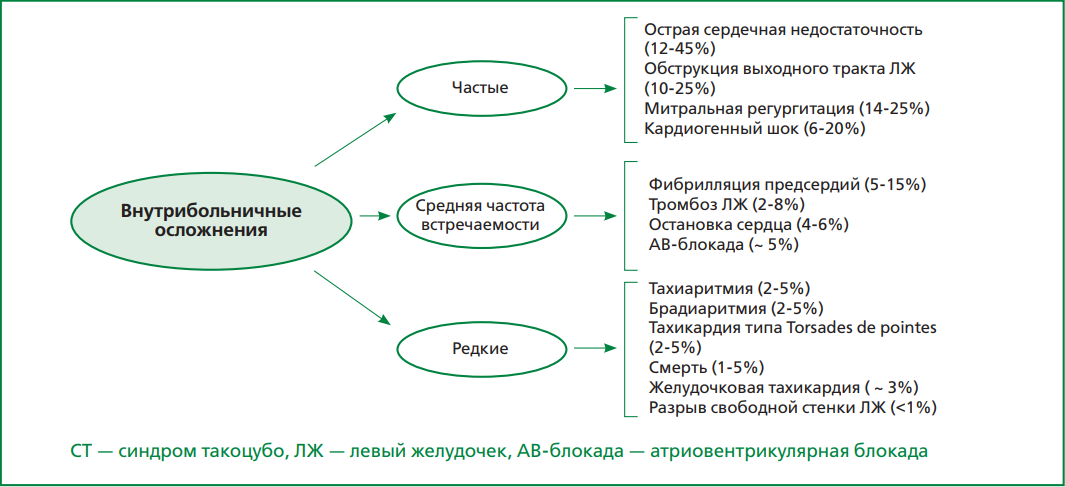
Рисунок 4. Внутрибольничные осложнения при СТ.
Согласно литературным данным, к наиболее значимым предикторам развития неблагоприятных исходов у пациентов с СТ относятся: возраст >70 лет, наличие физического пускового фактора, мужской пол, повышение уровней тропонина и мозгового натрийуретического пептида (МНУП), а также снижение фракции выброса ЛЖ <45% [10][11][18]. В настоящее время с целью стратификации риска внутрибольничных осложнений у пациентов с СТ предлагается использовать шкалу GEIST, разработанную на основании данных одноименного международного регистра. Она включает в себя оценку четырех факторов риска: мужской пол, наличие неврологических нарушений в анамнезе, значение фракции выброса (ФВ) ЛЖ, присутствие поражения ПЖ. Сумма баллов по шкале <20 соответствует категории пациентов низкого риска, 20-40 баллов — среднего, более 40 баллов — высокого риска развития внутрибольничных осложнений. Согласно результатам исследования, частота развития осложнений у пациентов высокого риска составляла 58,8% [19]. Кроме того, было показано, что пациенты с внутрибольничными осложнениями имели более высокий показатель смертности по сравнению с пациентами, не имевшими осложнений (40% и 10%, соответственно, р=0,01; период наблюдения 2,6 лет) [19]. Своевременное выявление пациентов категории высокого риска играет важную роль в выборе дальнейшей тактики ведения.
Диагностика
СТ остается одним из самых труднодиагностируемых состояний в практике кардиолога. Для верификации диагноза применяются такие параклинические тесты, как определение уровня сердечных биомаркеров (МНУП, тропонины), электрокардиография (ЭКГ), эхокардиография (ЭхоКГ), коронарная ангиография (КАГ) с вентрикулографией, магнитно-резонансная томография сердца (МРТ), компьютерная томографическая ангиография (КТА).
Лабораторная диагностика
Специфичных для стресс-индуцированной КМП лабораторных маркеров в настоящее время нет. Для пациентов с СТ на начальном этапе заболевания характерно повышение уровней тропонина I и Т, а также креатинфосфокиназы (КФК) крови. Однако, пиковые значения этих показателей ниже, чем у пациентов с ОКС. Таким образом, наблюдается диссонанс между концентрацией тропонинов и степенью дисфункции миокарда ЛЖ, что, по-видимому, обусловлено преходящим характером нарушений и отсутствием некроза миокарда [10][12][16][20]. Согласно мнению ряда авторов, более значимым биомаркером для диагностики КМП такоцубо является МНУП (BNP) или N-концевой промозговой натрийуретический пептид (В-типа) (NT-proBNP)). У пациентов, страдающих СТ, наблюдается выраженное повышение его концентрации в сыворотке крови, иногда до чрезвычайно высоких значений. Так, в работе C. Templin и соавт. у 82,9% пациентов с СТ при поступлении уровень МНУП был в среднем в 5,9 раз выше верхней границы нормы, что значительно превышало его средние значения, регистрируемые у пациентов с ОКС [10]. Следует отметить, что пиковых значений МНУП достигают через 24-48 ч после начала симптомов и может потребоваться несколько месяцев для их нормализации. В свою очередь степень повышения NT-proBNP напрямую зависит как от выраженности симпатической активности (оцениваемой по уровню норметанефрина), так и от выраженности систолической дисфункции ЛЖ. В научной литературе встречаются сведения о том, что у пациентов с «апикальным» вариантом СТ уровень NT-proBNP выше, чем при атипичной форме, что может быть обусловлено большей степенью дилатации ЛЖ [4][16][17][21].
Учитывая тот факт, что ни тропонины, ни NT-proBNP не могут служить самостоятельными маркерами при СТ, исследователи стали изучать возможность использования отношения NT-proBNP/сердечная изоформа тропонина T (cTnT) для дифференциальной диагностики СТ и ОКС. Так, L. S. Rallidis и соавт. показали, что отношение NT-proBNP/cTnT >7,5, измеренное на второй день госпитализации, с точностью >93% позволяет дифференцировать СТ и ИМ без подъема сегмента ST [22]. Однако, по мнению G. M. Frohlich и соавт., более высокую точность имеет отношение пиковых значений показателей [23]. Вместе с тем С. Pirlet и соавт. для верификации диагноза предлагают использовать отношение уровней высокочувствительного тропонина Т и КФК. Согласно полученным в их работе данным, отношение 0,017 с чувствительностью 83,3% и специфичностью 78,1% позволяет отличить СТ от ИМ [24].
Кроме вышеупомянутых маркеров в крови пациентов с СТ наблюдается повышенный уровень С-реактивного белка, который коррелирует с низкой ФВ ЛЖ, длительной госпитализацией и риском рецидива заболевания [25]. В настоящее время продолжается поиск специфичных для СТ новых биомаркеров, а кроме того, широко изучаются возможности уже известных показателей. По мнению O. Demirel и соавт., одним из перспективных маркеров являются белки теплового шока (heat shock protein? SP), в частности HSP70 [26]. Кроме того, появились работы, где для верификации СТ предлагается использования микроРНК (miR-16 и miR-26a) [27].
Электрокардиография
Наряду с клиническими проявлениями СТ имеет значительное сходство с ОКС в ЭКГ-картине, поэтому дифференциальная диагностика этих двух состояний требует особой внимательности. Изменения на ЭКГ наблюдаются более чем у 95% пациентов. Чаще всего регистрируются: инфарктоподобный подъем сегмента ST в прекардиальных отведениях, инверсия зубца Т и удлинение интервала QT (обычно развивается через 24-48 ч после начала симптомов), кроме того, иногда могут определяться зубец Q в передних грудных отведениях, депрессия сегмента ST (<10%), а также атриовентрикулярная блокада [12][16][28]. Согласно данным регистра RETAKO (Spanish REgistry for TAKOtsubo cardiomyopathy), включавшего 202 пациента с СТ, элевация сегмента ST наблюдалась у 61% пациентов, удлинение QT — у 79 %, инверсия зубца Т при поступлении отмечалась у 40%, а при повторной регистрации ЭКГ — у 94% пациентов [29]. В свою очередь, по результатам регистра InterTAK подъем сегмента ST, инверсия Т-волны отмечались у 44% и 41% пациентов, соответственно, вместе с тем у 8% имела место депрессия ST и у 5% — блокада левой ножки пучка Гиса [16].
Несмотря на значительное сходство ЭКГ-изменений при СТ с картиной при ОКС, они имеют и ряд своих особенностей. Так, элевация сегмента ST при СТ регистрируется чаще в отведениях II, V2-V5; тогда как при ОКС с подъемом сегмента ST в I, aVL, V1-V4 отведениях. Однако стоить иметь в виду, что крайне редко при СТ изменения сегмента ST могут быть ограничены нижними отведениями (II, III, aVF). В свою очередь, депрессия сегмента ST больше характерна для ОКС, чем для СТ [16][30]. C целью дифференциации стресс-индуцированной КМП и ОКС некоторые авторы рекомендуют использовать такие ЭКГ-критерии как: отсутствие реципрокных изменений и аномального зубца Q на ЭКГ; наличие элевации сегмента ST в отведении aVR (инвентированное отведение aVR) при ее отсутствии в V1 [30][31]. Характерной особенностью инвертированных зубцов Т при СТ является их преимущественная локализация в прекардиальных отведениях и в отличие от зубцов Т при ОКС они более глубокие [16]. Вместе с тем следует отметить, что у 14% пациентов с СТ отклонений на ЭКГ не наблюдается [16].
Эхокардиография
Одно из ключевых значений в диагностике стресс-индуцированной КМП занимает ЭхоКГ. Она позволяет оценить морфологию и функциональное состояние ЛЖ, вовлеченность ПЖ, выявить такие осложнения, как тромбоз ЛЖ, обструкция выносящего тракта ЛЖ и др.
На основании данных ЭхоКГ, в зависимости от локализации нарушений локальной сократимости, СТ подразделяют на следующие подтипы:
- Типичный или апикальный (81-86%), при котором наблюдаются: круговая дискинезия средних сегментов миокарда ЛЖ, баллонирование верхушечных сегментов и гиперконтрактильность базальных сегментов ЛЖ.
- Средневентрикулярный или его еще называют «щадящий верхушку» тип (11-17%). Он характеризуется гипо-, а- или дискинезией средних сегментов ЛЖ при нормо- или гиперкинезии базальных и верхушечных отделов [10][16][19][32].
- Базальный или инвертированный тип, для которого свойствен гипо-, а-, дискинез базальных отделов, наряду с нормо-/гиперкинезией апикальных сегментов ЛЖ (1,9-3%) отделов [10][16][19][32]. Иногда вариант СТ описывают как «мускатное» сердце [17]. Чаще встречается у пациентов с субарахноидальным кровоизлиянием или феохромоцитомой [1].
- Фокальный тип (1,5% случаев), характеризуется гипо-, а- или дискинезией любого сегмента ЛЖ (чаще переднелатерального) [1, 16].
- Бивентрикулярный тип и изолированное поражение ПЖ — крайне редко [1][16][33]. В работе D. Haghi и соавт. выявлено, что у пациентов с вовлеченным ПЖ при СТ чаще повреждались апикально-латеральный (89 %), передне-латеральный (67%) и нижний (67%) сегменты ПЖ. Следует отметить, что у пациентов с дисфункцией ПЖ наблюдаются более тяжелые нарушения систолической функции ЛЖ и неблагоприятный прогноз [33]. В другом исследовании, 113 пациентов с СТ (средний возраст 72,7±11,4 лет) на основании результатов ЭхоКГ были разделены на 2 группы: группа с бивентрикулярным поражением (n=21, 18,6%) и группа пациентов без вовлечения ПЖ (n=92, 81,4%). Согласно полученным данным частота внутрибольничной смертности была статистически значимо выше у пациентов с бивентрикулярной формой СТ (14,3% и 1,1%, соответственно, р=0,02). Кроме того, поражение ПЖ служило независимым предиктором развития неблагоприятного долгосрочного прогноза (относительный риск (RR): 2,73, при 95% доверительный интервал (ДИ): 1,13-6,62, р=0,026) [34].
Таким образом, ключевыми ЭхоКГ-признаками при СТ является значимая площадь дисфункции миокарда ЛЖ, как правило, выходящая за пределы кровоснабжения одной коронарной артерии (в отличие от ОКС) и симметричный, «круговой» характер нарушений региональной сократимости [1][17]. Следует отметить, что как правило, кинетические нарушения при СТ полностью восстанавливается через 4-8 нед.
Интересное исследование на основание данных регистра InterTak провели J. R. Ghadri и соавт. Суть работы заключалась в сравнительном анализе пациентов с типичной (81,7%) и атипичной (18,3%) формами СТ. Показано, что пациенты с атипичными формами СТ были моложе (средний возраст 62,5 и 67,3 лет, соответственно, р <0,001) и чаще имели сопутствующие неврологические нарушения (29,6% и 22,9%, соответственно, р=0,02). В свою очередь у пациентов с типичной формой СТ отмечались более высокий уровень МНУП и ниже ФВ ЛЖ. Однако, значимых различий между группами по этиологическому фактору, симптомам и частоте развития внутрибольничных осложнений выявлено не было [32]. В исследовании A. Uribarri и соавт. также сравнивались пациенты с различными вариантами СТ. Анализ полученных данных показал, что апикальный вариант чаще встречался у пациентов с первичным СТ или при СТ неясной этиологии (86,6% и 85,8%, соответственно). В свою очередь при вторичном СТ чаще регистрировались средневентриулярный и базальный подтипы. Причем средневентрикулярный вариант преобладал, если пусковым фактором выступали хирургические вмешательства, а базальный — если имели место неврологические нарушения. Вместе с тем апикальная форма заболевания чаще проявлялась при вторичном типе КМП, спровоцированной инфекцией или физической нагрузкой/травмой [11]. Еще одним интересным исследованием стала работа M. Arankesh и соавт., где был проведен сравнительный анализ СРС (n=1338) и ССС (n=57). Согласно результатам исследования у пациентов с ССС чаще регистрировалась средневентрикулярная форма СТ, тогда как при СРС — апикальная [35].
Следует подчеркнуть, что ЭхоКГ важна не только на этапе верификации диагноза, но и в последующем с целью мониторинга восстановления сократительной функции миокарда ЛЖ (особенно у пациентов с выраженной митральной регургитацией и с обструкцией выносящего тракта ЛЖ), а также для своевременного выявления осложнений. Согласно данным многофакторного анализа, проведенного R. Citro и соавт. у пациентов с СТ (n=227), такие ЭхоКГ-показатели, как низкая ФВ ЛЖ, отношение E/e′ и тяжелая митральная регургитация служат предикторами развития серьезных осложнений, в частности острой сердечной недостаточность, кардиогенного шока и внутрибольничной смертности [36]. В свою очередь анатомический вариант КМП не оказывает влияние на прогноз пациентов с СТ [32].
КАГ с вентрикулографией
Следующим не менее важным диагностическим инструментом является КАГ с вентрикулографией. В большинстве случаев она позволяет верифицировать диагноз СТ, при котором ключевым признаком является отсутствие гемодинамически значимого поражения коронарных артерий. Однако необходимо помнить, что в 10-29% случаев пациенты могут иметь сопутствующую обструктивную ИБС, и бывают ситуации, когда инфаркт миокарда может выступать провокатором в развитии СТ [1][12]. В связи с этим важным диагностическим критерием, который следует учитывать при анализе результатов КАГ служит то, что при СТ зона кинетических нарушений миокарда ЛЖ не соответствует бассейну кровоснабжения одной коронарной артерии [12]. Вместе с тем вентрикулография позволяет установить типичную для КМП картину нарушений сократимости миокарда. Примерно у 1/3 пациентов с апикальным баллонированием при вентрикулографии определяется признак «апикального соска», когда в наиболее дистальной части верхушки ЛЖ регистрируется небольшой участок с сохранной сократительной функцией [1][37]. С целью верификации обструкции выходного тракта ЛЖ, которая встречается примерно у каждого пятого пациента с СТ, во время вентрикулографии целесообразно проводить инвазивное измерение конечно-диастолического давления в ЛЖ, а также оценивать градиент давления в области выходного тракта ЛЖ [1].
В некоторых случаях, особенно при наличии у пациента угрожающих жизни сопутствующих заболеваний, таких как злокачественные новообразования, внутричерепное кровотечение, гипокоагуляционные состояния, тяжелый септический шок, более предпочтительным, чем КАГ методом визуализации служит КТА. Кроме того, ее применение оправдано при отсутствии возможности проведения КАГ, а также пациентам с подозрением на рецидив СТ, у которых по данным недавно проведенной КАГ не было выявлено обструктивного поражения коронарных артерий [1][38].
МРТ сердца с контрастированием гадолинием
В комплексной оценке функциональных и структурных нарушений, наблюдаемых у больных с СТ, немаловажную роль играет МРТ сердца с контрастированием гадолинием. Главным достоинством этого метода является способность оценить состояние миокардиальной ткани. Так, выявление при МРТ отека/воспаления миокарда, характерных для СТ, а не фиброза или некроза ткани (феномен позднего накопления гадолиния) позволяет отличить эту патологию от миокардита, инфаркта миокарда. Следует подчеркнуть, что при КМП такоцубо отек ткани не ограничивается областью нарушенной сократимости, а, хотя и в меньшей степени, но наблюдается по всему миокарду и держится обычно дольше, чем кинетические нарушения [38].
Кроме вышесказанного, МРТ служит ценным диагностическим инструментом при получении неясной ЭхоКГ-картины, а также превосходит ее в оценке состояния ПЖ и в выявлении апикального тромбоза ЛЖ [17]. В постострой фазе МРТ рекомендовано выполнять всем пациентам с СТ в течение 2 мес., особенно при сохранности изменений на ЭКГ и/или при ЭхоКГ-картине с целью подтверждения диагноза [38].
Таким образом, диагностика стресс-индуцированной КМП сложна, и мультимодальная визуализация играет здесь ключевую роль как в установлении верного диагноза, так и в определении дальнейшей стратегии ведения пациента.
Диагностические критерии
Вплоть до недавнего времени в качестве основных ориентиров при постановке диагноза СТ применялись критерии, разработанные специалистами клиники Mayo. Однако, в 2018 г. группа экспертов Европейского общества кардиологов представила консенсусный документ, посвященный СТ. В нем были предложены новые международные критерии диагностики СТ (табл.), основанные на данных регистра InterTak [1]. В отличие от критериев клиники Mayo, критерии InterTak допускают наличие у пациентов с СТ обструктивного поражения коронарного русла, а также возможную роль феохромоцитомы в качестве триггера.
Таблица. Диагностические критерии СТ
Критерии клиники Mayo | Критерии InterTak |
• Транзиторное нарушение систолической функции, характеризующееся выраженным ухудшением регионарной сократимости ЛЖ (акинезия или дискинезия апикальной области ЛЖ и/или средневерхушечных и базальных сегментов); • Нет значимого (>50%) поражения венечных артерий и свидетельств острого повреждения атеросклеротической бляшки; • Наличие отклонений на ЭКГ (элевации сегмента ST и/или инверсии зубцов Т); • Незначительное повышение значений биомаркеров повреждения миокарда; • Отсутствие феохромоцитомы; • Исключение миокардита или типичного для ишемии, позднего трансмурального накопления гадолиния на основании данных МРТ сердца. | • Преходящие нарушения сократимости миокарда ЛЖ (гипокинез, дискинез или акинез), проявляющиеся различными анатомическими вариантами СТ. Возможно поражение ПЖ. В редких случаях (при фокальном типе СТ) зона кинетических нарушений соответствует бассейну кровоснабжения одной коронарной артерии; • Предшествовать развитию СТ может эмоциональный/физический или комбинированный пусковой фактор. Тем не менее это условие не является необходимым; • В качестве пускового фактора могут выступать феохромоцитома, а также такие неврологические заболевания, как инсульт, транзиторная ишемическая атака, судороги, субарахноидальное кровоизлияние; • Появление на ЭКГ элевации или депрессии сегмента ST, инверсии Т-волны, удлиненного интервала QT. Однако, иногда ЭКГ-признаки могут отсутствовать; • Умеренное повышеяние в крови уровней тропонина и КФК, наряду со значительным увеличением концентрации НУП (BNP или NT-proBNP); • Наличие обструктивного поражения коронарных артерий не исключает диагноз СТ; • У пациентов отсутствуют проявления инфекционного миокардита, для исключения которого рекомендуется использовать МРТ сердца; • В основном страдают женщины постменопаузального периода. |
КФК — креатининфосфокиназа, ЛЖ — левый желудочек, МРТ — магнитно-резонансная томография, НУП — натрийуретический пептид, ПЖ — правый желудочек, СТ — синдром такоцубо, ЭКГ — электрокардиография, BNP — мозговой натрийуретический пептид, | |
Помимо вышеизложенных критериев, в консенсусном документе представлен разработанный экспертами алгоритм диагностики СТ [1]. В соответствии с ним, если у пациента на ЭКГ регистрируется подъем сегмента ST, для исключения острого ИМ рекомендуется срочная КАГ с вентрикулографией. Однако, в случае если на ЭКГ отсутствует элевация сегмента ST, для оценки вероятности диагноза СТ предлагается использовать шкалу стратификации риска InterTak. Она включает в себя 7 параметров, каждому из которых присваивается определенное количество баллов: женский пол (25 баллов), наличие эмоционального (24 балла) или физического стресса (13 баллов), отсутствие депрессии сегмента ST (за исключением aVR отведения, 12 баллов), удлинением интервала QT (6 баллов), наличие психических (11 баллов) или неврологических нарушений (9 баллов). При сумме баллов по шкале ≥70, вероятность наличия СТ составляет ~90% и таким пациентам первым этапом рекомендуется проведение ЭхоКГ. При наличии у пациента типичной для стрессовой КМП ЭхоКГ-картины и стабильном состоянии вторым этапом, для оценки коронарной анатомии предпочтительнее использовать КТА. Если полученные данные исключают наличие обструктивного поражения в коронарных артериях, но у пациента наблюдаются признаки инфекционного миокардита, с целью верификации диагноза необходимо проведение МРТ сердца. В свою очередь нестабильным пациентам рекомендовано проведение КАГ с вентрикулографией как для надежного исключения ОКС, так и для своевременного выявления осложнений (в частности, обструкции выносящего тракта ЛЖ, апикального тромбоза и др.) [1].
Заключение
Стрессовая КМП представляет собой сложную сердечно-сосудистую патологию с широким спектром клинических проявлений, что требует от врача разработки индивидуальных диагностических и терапевтических стратегий. Однако, несмотря на рост числа клинических исследований, медицинское сообщество по-прежнему имеет неполное представление об этиологии и механизмах, лежащих в основе СТ. Недостаток информации о надежных и действенных способах профилактики и терапии данного состояния требует проведения дальнейших крупномасштабных клинических исследований, которые позволят разрешить сложившиеся вопросы и создать рекомендации по ведению этой категории пациентов.
Список литературы
1. Ghadri JR, Wittstein IS, Prasad A, et al. International Expert Consensus Document on Takotsubo Syndrome (Part I): Clinical Characteristics, Diagnostic Criteria, and Pathophysiology. Eur Heart J. 2018;39(22):2032-46. DOI:10.1093/eurheartj/ehy076.
2. Yalta K, Madias JE, Kounis NG, et al. Takotsubo Syndrome: An International Expert Consensus Report on Practical Challenges and Specific Conditions (Part- 1: Diagnostic and Therapeutic Challenges). Balkan Med J. 2024;41(6):421-41. DOI:10.4274/balkanmedj.galenos.2024.2024-9-98.
3. Jabri A, Kalra A, Kumar A, et al. Incidence of Stress Cardiomyopathy During the Coronavirus Disease 2019 Pandemic. JAMA Netw Open. 2020;3(7):e2014780. DOI:10.1001/jamanetworkopen.2020.14780.
4. Singh T, Khan H, Gamble DT, et al. Takotsubo Syndrome: Pathophysiology, Emerging Concepts, and Clinical Implications. Circulation. 2022;145(13):1002- 19. DOI:10.1161/CIRCULATIONAHA.121.055854. Erratum in: Circulation. 2022;145(20):e1053. DOI:10.1161/CIR.0000000000001075.
5. Cammann VL, Szawan KA, Stähli BE, et al. Age-Related Variations in Takotsubo Syndrome. J Am Coll Cardiol. 2020;75(16):1869-77. DOI:10.1016/j.jacc.2020.02.057.
6. Nazir S, Ahuja KR, Soni RG, et al. Age-Related Variations in Takotsubo Syndrome in the United States. Am J Cardiol. 2020;133:168-70. DOI:10.1016/j.amjcard.2020.07.023
7. El-Battrawy I, Santoro F, Núñez-Gil IJ, et al. Age-Related Differences in Takotsubo Syndrome: Results From the Multicenter GEIST Registry. J Am Heart Assoc. 2024;13(4):e030623. DOI:10.1161/JAHA.123.030623.
8. илова А.С., Шмоткина А.О., Яфарова А.А., Гиляров М.Ю. Синдром такоцубо: современные представления о патогенезе, распространенности и прогнозе. Рациональная Фармакотерапия в Кардиологии 2018;14(4):598- 604. DOI:10.20996/1819-6446-2018-14-4-598-604.
9. Qin D, Patel SM, Champion HC. “Happiness” and stress cardiomyopathy (apical ballooning syndrome/takotsubo syndrome). Int J Cardiol. 2014;172(1):e182-3. DOI:10.1016/j.ijcard.2013.12.140.
10. Templin C, Ghadri JR, Diekmann J, et al. Clinical Features and Outcomes of Takotsubo (Stress) Cardiomyopathy. N Engl J Med. 2015;373(10):929-38. DOI:10.1056/NEJMoa1406761.
11. Uribarri A, Núñez-Gil IJ, Conty DA, et al. Short- and Long-Term Prognosis of Patients With Takotsubo Syndrome Based on Different Triggers: Importance of the Physical Nature. J Am Heart Assoc. 2019;8(24):e013701. DOI:10.1161/JAHA.119.013701.
12. Giubilato S, Francese GM, Manes MT, et al. Takotsubo Syndrome and Gender Differences: Exploring Pathophysiological Mechanisms and Clinical Differences for a Personalized Approach in Patient Management. J Clin Med. 2024;13(16):4925. DOI:10.3390/jcm13164925.
13. Zyani A, Mzaalak Tazi O, Alkouh R, et al. Post-traumatic Takotsubo Cardiomyopathy in a Pediatric Patient: A Rare Case and Diagnostic Challenge. Cureus. 2024;16(11):e74802. DOI:10.7759/cureus.74802.
14. Sendi P, Martinez P, Chegondi M, Totapally BR. Takotsubo cardiomyopathy in children. Cardiol Young. 2020;30(11):1711-5. DOI:10.1017/S1047951120002632.
15. Ghadri JR, Kato K, Cammann VL, et al. Long-Term Prognosis of Patients With Takotsubo Syndrome. J Am Coll Cardiol. 2018;72(8):874-82. DOI:10.1016/j.jacc.2018.06.016.
16. Ghadri JR, Wittstein IS, Prasad A, et al. International Expert Consensus Document on Takotsubo Syndrome (Part II): Diagnostic Workup, Outcome, and Management. Eur Heart J. 2018;39(22):2047-62. DOI:10.1093/eurheartj/ehy077.
17. Lyon AR, Bossone E, Schneider B, et al. Current state of knowledge on Takotsubo syndrome: a Position Statement from the Taskforce on Takotsubo Syndrome of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2016;18(1):8-27. DOI:10.1002/ejhf.424.
18. Arcari L, Núñez Gil IJ, Stiermaier T, et al. Gender Differences in Takotsubo Syndrome. J Am Coll Cardiol. 2022;79(21):2085-93. DOI:10.1016/j.jacc.2022.03.366.
19. Santoro F, Núñez Gil IJ, Stiermaier T, et al. Assessment of the German and Italian Stress Cardiomyopathy Score for Risk Stratification for In-hospital Complications in Patients With Takotsubo Syndrome. JAMA Cardiol. 2019;4(9):892-899. DOI:10.1001/jamacardio.2019.2597. Erratum in: JAMA Cardiol. 2019;4(11):1180. DOI:10.1001/jamacardio.2019.3881.
20. Couch LS, Garrard JW, Henry JA, et al. Comparison of troponin and natriuretic peptides in Takotsubo syndrome and acute coronary syndrome: a meta-analysis. Open Heart. 2024;11(1):e002607. DOI:10.1136/openhrt-2024-002607.
21. Nguyen TH, Neil CJ, Sverdlov AL, et al. N-terminal pro-brain natriuretic protein levels in takotsubo cardiomyopathy. Am J Cardiol. 2011;108(9):1316-21. DOI:10.1016/j.amjcard.2011.06.047.
22. Rallidis LS, Iordanidis D, Papathanasiou KA, et al. NT-proBNP/cardiac troponin T ratio >7.5 on the second day of admission can differentiate Takotsubo from acute coronary syndrome with good accuracy. Hellenic J Cardiol. 2024;76:22-30. DOI:10.1016/j.hjc.2023.05.010.
23. Fröhlich GM, Schoch B, Schmid F, et al. Takotsubo cardiomyopathy has a unique cardiac biomarker profile: NT-proBNP/myoglobin and NT-proBNP/ troponin T ratios for the differential diagnosis of acute coronary syndromes and stress induced cardiomyopathy. Int J Cardiol. 2012;154(3):328-32. DOI:10.1016/j.ijcard.2011.09.077.
24. Pirlet C, Pierard L, Legrand V, Gach O. Ratio of high-sensitivity troponin to creatine kinase-MB in takotsubo syndrome. Int J Cardiol. 2017;243:300-5. DOI:10.1016/j.ijcard.2017.05.107.
25. Moady G, Yelin B, Sweid R, Atar S. C-Reactive Protein Can Predict Outcomes in Patients With Takotsubo Syndrome. Int J Heart Fail. 2023;6(1):28-33. DOI:10.36628/ijhf.2023.0033.
26. Demirel O, Paar V, Tolnai P, et al. Heat Shock Protein 70 Constitutes a Promising Novel Biomarker in Differential Diagnosis between Takotsubo Syndrome and Non-ST-Segment Elevation Myocardial Infarction. J Clin Med. 2024;13(14):4152. DOI:10.3390/jcm13144152.
27. Jaguszewski M, Osipova J, Ghadri JR, et al. A signature of circulating microRNAs differentiates takotsubo cardiomyopathy from acute myocardial infarction. Eur Heart J. 2014;35(15):999-1006. DOI:10.1093/eurheartj/eht392.
28. Namgung J. Electrocardiographic Findings in Takotsubo Cardiomyopathy: ECG Evolution and Its Difference from the ECG of Acute Coronary Syndrome. Clin Med Insights Cardiol. 2014;8:29-34. DOI:10.4137/CMC.S14086.
29. Núñez Gil IJ, Andrés M, Almendro Delia M, et al. Characterization of Tako-tsubo Cardiomyopathy in Spain: Results from the RETAKO National Registry. Rev Esp Cardiol (Engl Ed). 2015;68(6):505-12. DOI:10.1016/j.rec.2014.07.026.
30. Kosuge M, Ebina T, Hibi K, et al. Simple and accurate electrocardiographic criteria to differentiate takotsubo cardiomyopathy from anterior acute myocardial infarction. J Am Coll Cardiol. 2010;55(22):2514-6. DOI:10.1016/j.jacc.2009.12.059.
31. Çatalkaya Demir S, Demir E, Çatalkaya S. Electrocardiographic and Seasonal Patterns Allow Accurate Differentiation of Tako-Tsubo Cardiomyopathy from Acute Anterior Myocardial Infarction: Results of a Multicenter Study and Systematic Overview of Available Studies. Biomolecules. 2019;9(2):51. DOI:10.3390/biom9020051.
32. Ghadri JR, Cammann VL, Napp LC, et al.; International Takotsubo (InterTAK) Registry. Differences in the Clinical Profile and Outcomes of Typical and Atypical Takotsubo Syndrome: Data From the International Takotsubo Registry. JAMA Cardiol. 2016;1(3):335-40. DOI:10.1001/jamacardio.2016.0225.
33. Haghi D, Athanasiadis A, Papavassiliu T, et al. Right ventricular involvement in Takotsubo cardiomyopathy. Eur Heart J. 2006;27(20):2433-9. DOI:10.1093/eurheartj/ehl274.
34. Kagiyama N, Okura H, Tamada T, et al. Impact of right ventricular involvement on the prognosis of takotsubo cardiomyopathy. Eur Heart J Cardiovasc Imaging. 2016;17(2):210-6. DOI:10.1093/ehjci/jev145.
35. Mahadevan A, Borra V, Prasanna Vaishnavi Kattamuri L, et al. A Comparative Analysis of Positive and Negative Stimuli for Takotsubo Cardiomyopathy: A Pooled Analysis of Two Studies and a Systematic Review. Cureus. 2024;16(4):e57816. DOI:10.7759/cureus.57816.
36. Citro R, Rigo F, D’Andrea A, et al. Echocardiographic correlates of acute heart failure, cardiogenic shock, and in-hospital mortality in tako-tsubo cardiomyopathy. JACC Cardiovasc Imaging. 2014;7(2):119-29. DOI:10.1016/j.jcmg.2013.09.020.
37. Desmet W, Bennett J, Ferdinande B, et al. The apical nipple sign: a useful tool for discriminating between anterior infarction and transient left ventricular ballooning syndrome. Eur Heart J Acute Cardiovasc Care. 2014;3(3):264-7. DOI:10.1177/2048872613517359.
38. Citro R, Okura H, Ghadri JR, et al. Multimodality imaging in takotsubo syndrome: a joint consensus document of the European Association of Cardiovascular Imaging (EACVI) and the Japanese Society of Echocardiography (JSE). J Echocardiogr. 2020;18(4):199-224. DOI:10.1007/s12574-020-00480-y. Erratum in: J Echocardiogr. 2020;18(4):225. DOI:10.1007/s12574-020-00503-8.
Об авторах
Н. М. АбдужамаловаРоссия
Абдужамалова Наргиз Магомедгусеновна
Москва
М. Н. Мамедов
Россия
Мамедов Мехман Ниязиевич
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Абдужамалова Н.М., Мамедов М.Н. Новые аспекты диагностики синдрома такоцубо. Рациональная Фармакотерапия в Кардиологии. 2025;21(3):289-297. https://doi.org/10.20996/1819-6446-2025-3188. EDN: MOYAUD
For citation:
Abduzhamalova N.M., Mamedov M.N. New aspects in the diagnosis of takotsubo syndrome. Rational Pharmacotherapy in Cardiology. 2025;21(3):289-297. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3188. EDN: MOYAUD

















































