ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
Цель. Оценить приверженность медикаментозной терапии, получение льготного лекарственного обеспечения (ЛЛО), а также выявить факторы, влияющие на приверженность пациентов лечению в течение года после инфаркта миокарда (ИМ).
Материал и методы. Наблюдательное многоцентровое исследование включало выборку пациентов с ИМ, госпитализированных в 13 регионах Российской Федерации с июня 2015 по август 2016 гг. — 1107 пациентов с ИМ в возрасте 35-75 лет. С помощью шкалы Мориски-Грин (MMAS-4) выполнен анализ приверженности лечению 889 пациентов через 12 мес. после ИМ. Также собирались анамнестические данные, проводился опрос на предмет получения ЛЛО для выявления факторов, ассоциированных с высокой приверженностью лечению.
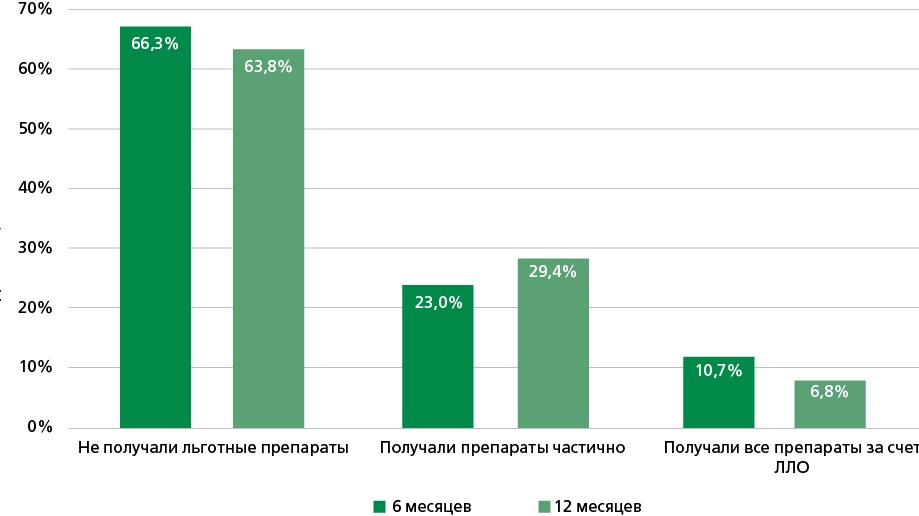
Результаты. Через 12 мес. после перенесенного ИМ 59,9% пациентов были полностью привержены лечению, 21,8% — недостаточно привержены и 18,3% — не привержены медикаментозной терапии. Мужчины менее привержены лечению по сравнению с женщинами (p=0,003), молодые пациенты менее привержены по сравнению со старшей возрастной группой (p=0,028). Полностью лекарственные препараты за счет ЛЛО через 6 мес. получали 10,7%, через 12 мес. — 6,5% пациентов. Статистически значимо чаще льготные препараты получали лица старшей возрастной группы (р<0,001) и женщины (p=0,006). Факторами, ассоциированными с получением ЛЛО, оказались контакты с системой здравоохранения: наблюдение терапевтом (отношение шансов (ОШ) 1,53; доверительный интервал (ДИ): 1,01-2,34; p=0,044), кардиологом (ОШ 1,61; ДИ: 1,04-2,51; p=0,035), диспансерное наблюдение (ОШ 3,56; ДИ: 2,2-6,22; p<0,001), повторная госпитализация (ОШ 1,57; ДИ: 1,03-2,39; p=0,036). Единственным фактором, статистически значимо ассоциированным со снижением вероятности получения ЛЛО, оказалось курение (ОШ 0,54; ДИ: 0,33-0,9; p=0,018). Фактором, статистически значимо связанным с высокой приверженностью лечению, оказался перенесенный инсульт (ОШ 5,89; ДИ: 1,75-36,76; p=0,016). Получение ЛЛО на протяжении года после ИМ статистически значимо не влияло на приверженность (ОШ 1,03; ДИ: 0,66-1,61; p=0,902).
Заключение. Выявлена недостаточная приверженность пациентов лечению в течение года после ИМ. Менее привержены лечению мужчины и молодые пациенты. Наблюдается небольшая доля полного ЛЛО (6,5%), однако на момент проведения исследования пациенты с ИМ без инвалидности и социальных льгот не попадали под программы ЛЛО. Значимо чаще ЛЛО получали пациенты, контактировавшие с системой здравоохранения: те, кто был на приеме кардиолога или терапевта, состоял на диспансерном наблюдении, был повторно госпитализирован. Единственным фактором, значимо ассоциированным со снижением вероятности получения ЛЛО, оказалось курение. Среди факторов, значимо ассоциированных с высокой приверженностью лечению, можно выделить наличие инсульта в анамнезе. Получение же ЛЛО на протяжении года после ИМ значимо не влияло на приверженность.
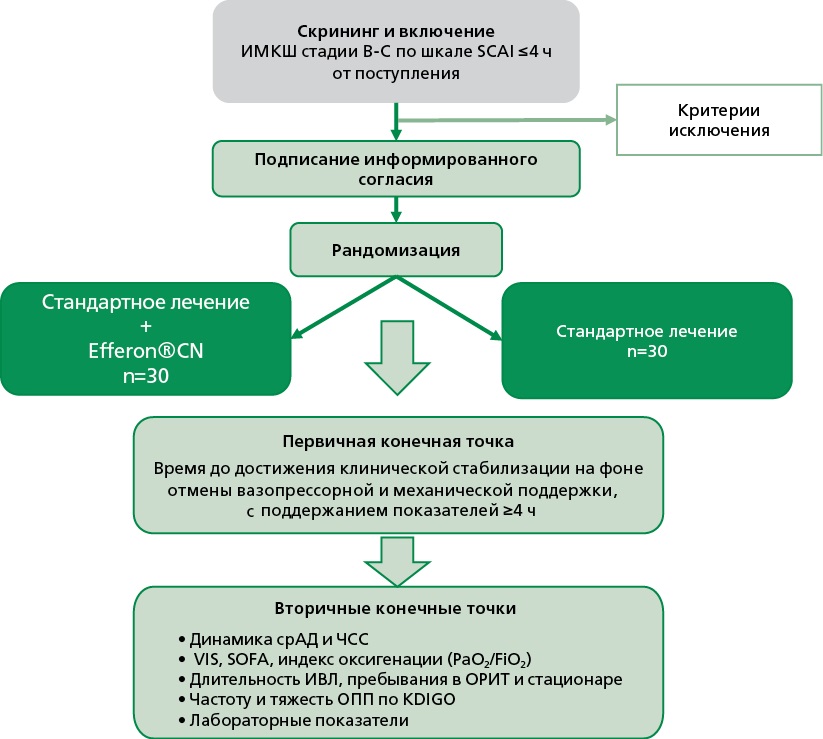
Цель. Оценить эффективность и безопасность гемосорбции с использованием устройства Efferon®CT у пациентов с инфаркт миокарда-ассоциированным кардиогенным шоком, стадий B-C по классификации Society for Cardiovascular Angiography and Interventions (SCAI).
Материал и методы. Представлен протокол открытого рандомизированного контролируемого одноцентрового клинического исследования. В исследование планируется включить 60 пациентов в возрасте 18-80 лет, с диагнозом инфаркт миокарда-ассоциированный кардиогенный шок, установленным не позднее чем за 4 ч до рандомизации. Пациенты будут распределены в основную группу (стандартная терапия + гемосорбция, n=30) и контрольную группу (стандартная терапия, n=30). Первичная конечная точка: время до клинической стабилизации (нормализация гемодинамики с отменой вазопрессорной и механической поддержки, устойчивый эффект ≥4 ч). Вторичные конечные точки: динамика гемодинамических параметров, индекс оксигенации, балл по шкале оценки тяжести органной дисфункции (Sequential Organ Failure Assessment, SOFA), показатели острого почечного повреждения (Kidney Disease: Improving Global Outcomes, KDIGO), продолжительность и потребность в искусственной вентиляции легких, длительность пребывания в отделении реанимации и стационаре, динамика воспалительных и органоспецифических маркеров.
Ожидаемые результаты. Удаление провоспалительных медиаторов средней массы с помощью Efferon®CT позволит улучшить макро- и микроциркуляцию, снизить выраженность полиорганной дисфункции и уменьшить потребность в вазоактивной поддержке.
Заключение: Планируемое исследование направлено на оценку роли гемосорбции в терапии инфаркт миокарда-ассоциированного кардиогенного шока. При положительных результатах метод может стать основой для дальнейших мультицентровых исследований и пересмотра существующих рекомендаций по ведению данной категории пациентов.
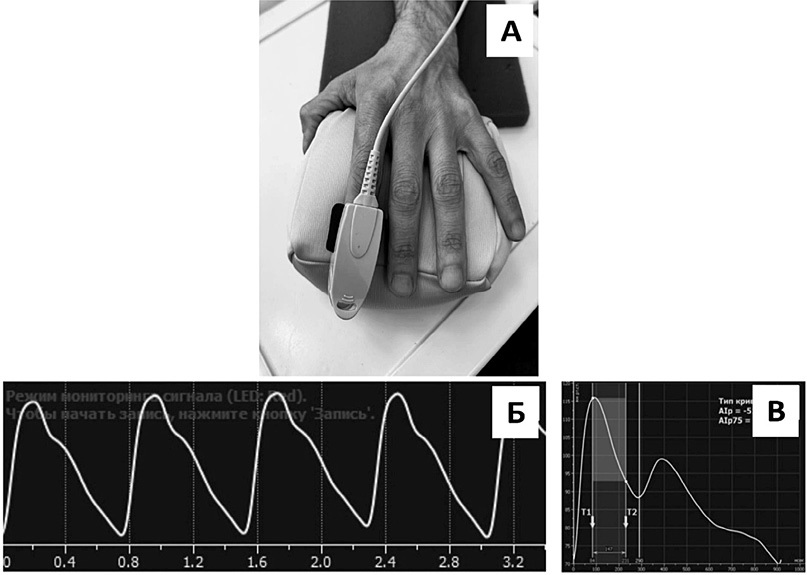
Цель. Изучить функциональное состояние терминальных мышечных артерий и распределительных артериол кожи методом фотоплетизмографии (ФПГ) «на просвет» у мужчин трудоспособного возраста с различным уровнем психосоциального стресса (ПС).
Материал и методы. 200 мужчинам (50,9±1,0 лет) проведены: объективный осмотр, антропометрия, оценка уровня ПС с помощью теста Ридера (Reeder) в адаптации Копиной О. С., биохимический анализ крови (холестерин и липидный профиль, глюкоза, С-реактивный белок), суточное мониторирование артериального давления и ФПГ «на просвет» указательного пальца левой кисти. Все обследуемые были классифицированы на 5 упорядоченных групп в зависимости от распределения показателей стресса по квинтилям: 1-ю группу составили 43 мужчины с низким уровнем стресса (3,57-4,0 балла), 2-ю – 38 мужчин со средне-низким уровнем (3,28-3,43 балла), 3-ю – 41 мужчина со средним уровнем (2,9-3,14 балла), 4-ю – 47 мужчин со средне-высоким уровнем (2,57-2,9 балла) и 5-ю – 31 мужчина с высоким уровнем стресса (1,43-2,57 балла).
Результаты. Продемонстрировано статистически значимое увеличение скорости распространения пульсовой волны (aSI) у мужчин трудоспособного возраста по мере увеличения уровня ПС (р=0,042), а также незначимый тренд к большей сосудистой жесткости (Alp75) терминальных мышечных артерий и распределительных артериол в группах среднего и средне-высокого уровня ПС (р=0,089). Далее был проведен множественный регрессионный анализ с поправкой на индекс массы тела, суточное мониторирование артериального давления, курение, уровень холестерина, лекарственную терапию, который продемонстрировал, что артериальная жесткость (Alp75) больше в группах среднего (В=6,18; р=0,026) и средне-высокого (В=6,27; р=0,023) уровня ПС по сравнению с высоким. Значимых ассоциаций уровня ПС со скоростью распространения пульсовой волны (aSI) и тонусом гладкомышечных клеток (RI) терминальных мышечных артерий и распределительных артериол кожи у мужчин трудоспособного возраста не выявлено.
Заключение. У мужчин трудоспособного возраста со средним и средне-высоким уровнем ПС увеличение сосудистой жесткости, помимо эластических и крупно-эластических артерий, может развиваться и на уровне терминальных мышечных артерий и распределительных артериол кожи. Снижение уровня ПС с возможным сопутствующим уменьшением артериальной жесткости с целью снижения риска развития и прогрессирования сердечно-сосудистых заболеваний и улучшения качества жизни пациентов представляется актуальной терапевтической задачей.
Цель. Изучить ассоциации уровня N-концевого промозгового натрийуретического пептида (NT-proBNP) с показателями состава тела в сравнении с индексом массы тела (ИМТ) у мужчин с хронической сердечной недостаточностью (ХСН).
Материал и методы. В исследование включено 60 мужчин с ХСН различного генеза с низкой и промежуточной фракцией выброса (ФВ) левого желудочка (ЛЖ) в возрасте 20-70 лет. ИМТ вычисляли по формуле Кетле: ИМТ = масса тела (кг)/рост (м2). Количественный состав тела (жировая, мышечная и костная масса) определяли с помощью двухэнергетической рентгеновской абсорбциометрии. Для определения уровня NT-proBNP применялся метод хемилюминисцентного иммуноферментного анализа с использованием технологии MAGTRATION.
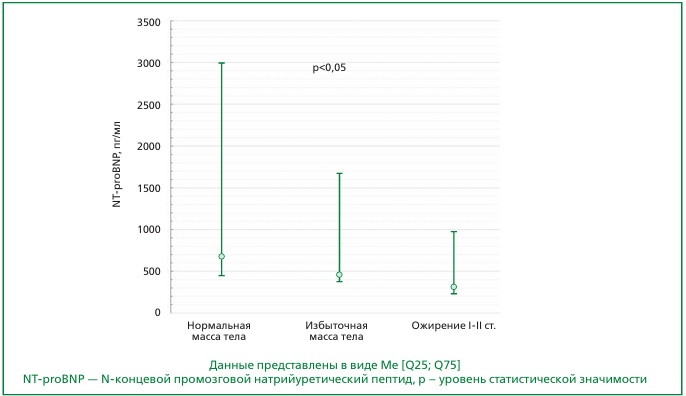
Результаты. Уровень NT-proBNP у мужчин с нормальной массой тела был статистически значимо выше, чем у лиц с избыточной массой тела и ожирением (680 [427; 2994], 446 [381; 1667], 300 [226; 967] пг/мл (р<0,05) соответственно). Количество как жировой, так и мышечной массы было значимо выше у лиц с ожирением, однако при линейном регрессионном анализе с поправкой на возраст уровень NT-proBNP был независимо ассоциирован только с аппендикулярной мышечной массой и индексом аппендикулярной скелетной мускулатуры.
Заключение. Пациенты с ХСН и ожирением имеют более низкие значения NT-proBNP, чем лица с нормальной массой тела. Продемонстрирована независимая обратная ассоциация уровня NT-proBNP с ИМТ и с показателями мышечной, но не жировой массы тела. Полученные данные свидетельствуют о вкладе мышечного компонента массы тела в более низкие значения NT-proBNP у лиц с ХСН и высоким ИМТ.
Цель. Оценить влияние раннего назначения эмпаглифлозина — с 1-х суток лечения острой декомпенсации сердечной недостаточности (ОДСН) на исходы через 3 и 6 мес.
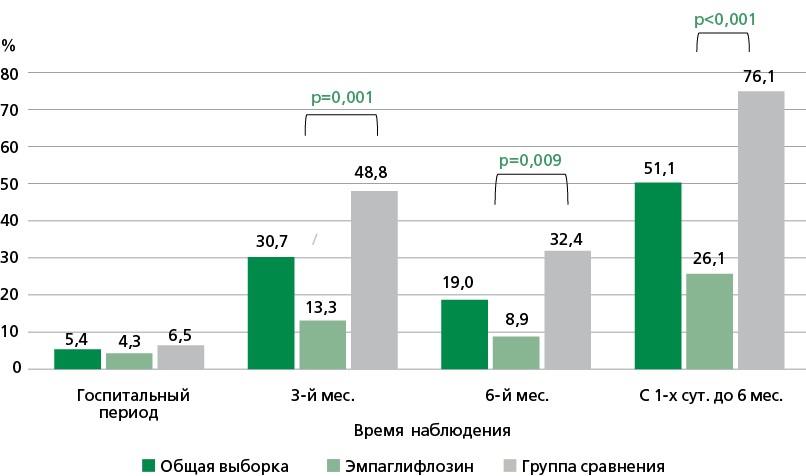
Материал и методы. В исследование включено 92 пациента, поступивших в стационар с диагнозом ОДСН при отсутствии показателей гемодинамической нестабильности. В 1-е сутки госпитализации пациенты включались в исследование и были рандомизированы к приему эмпаглифлозина в суточной дозе 10 и 25 мг (в случае неэффективного гликемического контроля для пациентов с сахарным диабетом 2 типа) на две равночисленные группы. Пациенты группы сравнения получали лечение без глифлозинов в госпитальном периоде исследования, однако при выписке из стационара был рекомендован прием эмпаглифлозина либо дапаглифлозина наряду с другими назначениями, при этом 8 больных начали прием препарата данного класса: 7 — в течение 3 мес. после выписки из стационара, 1 — в период 3-го — 6-го мес. исследования. У всех участников проводился сбор сведений о развитии неблагоприятных сердечно-сосудистых событий и хирургических вмешательств по поводу сердечно-сосудистых заболеваний, а также побочных и нежелательных явлений на фоне терапии эмпаглифлозином на каждом из этапов наблюдения — стационарного и амбулаторного (3 и 6 мес. после выписки из стационара).
Результаты. Из 92 участников исследования за период 6 мес. отмечено 18 (19,6%) летальных исходов (все по причине ОДСН), 9 (9,8%) нефатальных сердечно-сосудистых событий. За весь период наблюдения в группе пациентов, принимающих эмпаглифлозин, было отмечено меньшее количество всех случаев неблагоприятных сердечно-сосудистых событий (26,1% vs 76,1%, р <0,001). Анализ Каплана—Мейера показал значимые различия в выживаемости, а также во времени наступления любого неблагоприятного события (летальный исход или нефатальное событие) в зависимости от приема эмпаглифлозина в течение 6 мес. после эпизода ОДСН: 6,5% vs 32,6% (р=0,002) и 15,2% vs 43,5% (р=0,003), соответственно. При анализе исходов в отдельные периоды исследования (день выписки — 3 мес.; 3 — 6 мес.) частота неблагоприятных событий была значимо меньше в основной группе (13,3% vs 48,8%, р=0,001; 8,9% vs 32,4%, р=0,009, соответственно), а также отмечена разница по частоте летальных исходов на 3 мес. (0% vs 20,9%) и нефатальных событий на 6 мес. (0% vs 14,7%) в зависимости от приема эмпаглифлозина. На фоне терапии побочных реакций и нежелательных явлений зарегистрировано не было.
Заключение. Лечение пациентов с ОДСН эмпаглифлозином в дозе 10 мг/сут. с 1-х суток госпитализации безопасно и улучшает прогноз (летальный исход и повторные эпизоды ОДСН) через 3 и 6 мес. после выписки из стационара.
Цель. Оценить прогностическое значение изменения левого предсердия (ДЛП) в фазе резервуара для прогнозирования риска серьезных неблагоприятных сердечно-сосудистых событий у пациентов с сахарным диабетом 2 типа и промежуточной сердечной недостаточностью с сохраненной фракцией выброса (СНсФВ) в течение 1 года наблюдения.
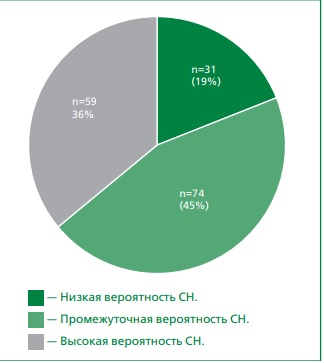
Материал и методы. В проспективном исследовании первоначально было скринировано 164 пациента с сахарным диабетом 2 типа (средний возраст — 61±8 лет), предъявляющих жалобы на одышку и подтвержденных при эхокардиографии сохраненную фракцию выброса левого желудочка (≥50%). После оценки по шкале HFA-PEFF при наличии 1 балла и менее диагноза СНсФВ считается маловероятным, ≥5 баллов — подтвержденным. В окончательную выборку вошли 58 пациентов с промежуточной тестированием СН (2-4 балла), которым проводилось стандартное клиническое исследование, включая лабораторные и инструментальные методы, а также диастолический стресс-эхокардиографический тест (ДСТ) с физикальным определением по горизонтальным велоэргометрам для постановки диагноза СНсФВ. Положительное ДСТИ повышение значения Е/e' ≥15 на фоне нагрузки (2 балла) или повышение Е/e' ≥15 с одновременным изменением скорости ТР >3,4 м/с (3 балла). ДЛП измерялась методом спекл-трекинговой эхокардиографии с акцентом на резервуарную функцию. Аномальные значения установлены на уровне ≤18% для ДЛП.
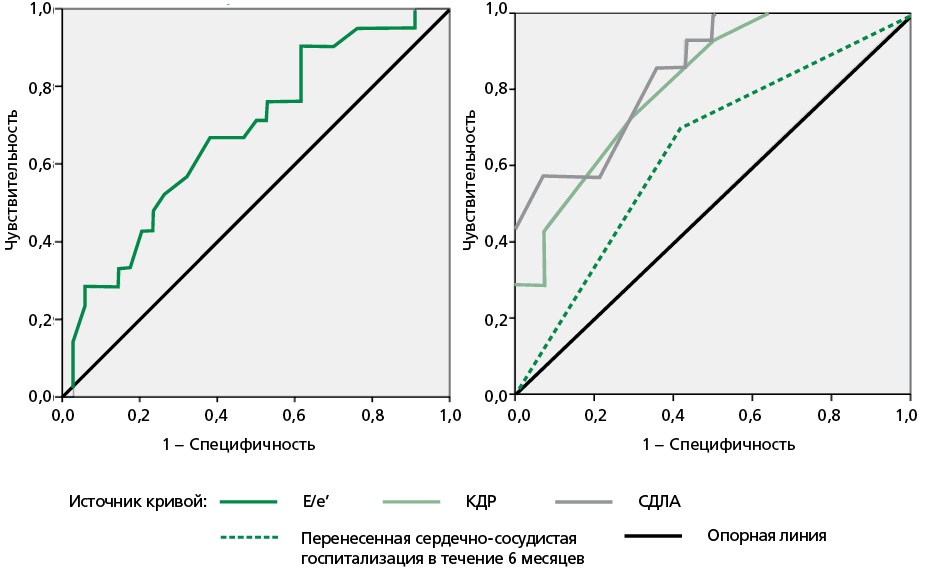
Результаты. По данным ДСТ, у 29,3% пациентов был зарегистрирован положительный результат, что является источником диагностировать СНсФВ. В этой группе отмечаются более низкие показатели ДЛП как в покое, так и при странах. Установлено, что снижение ДЛП на фоне физической нагрузки коррелирует с повышением давления наполнения левого желудочка. Кроме того, ДЛП продемонстрировала независимую прогностическую ценность в отношении риска неблагоприятных событий. Анализ кривых Каплана–Мейера выявил характерную значимую связь между ДЛП ≤18% и риском достижения сочетанной конечной точки в группе пациентов с СНсФВ (логарифмический ранг = 14,72; p <0,001).
Заключение. У пациентов с сахарным диабетом 2 типа и промежуточной нагрузкой снижение СНсФВ ДЛП в фазе резервуара (<18%) является значимым предиктором неблагоприятных событий в течение года наблюдения.
Цель. Изучить биомаркерный профиль, клинические и эхокардиографические характеристики пациентов кардиоренометаболического фенотипа хронической сердечной недостаточности с сохраненной фракцией выброса (ХСНсФВ), их влияние на полугодовой прогноз.
Материал и методы. Проведено проспективное исследование 80 пациентов кардиоренометаболического профиля ХСНсФВ. Проанализированы анамнез, клинико-демографические данные, сопутствующая патология, выполнен иммуноферментный анализ сыворотки крови для определения концентраций N-концевого промозгового натрийуретического пептида (NT-proBNP), галектина-3, растворимой формы супрессора туморогенности 2 (sST2), фактора, индуцируемого гипоксией 1-альфа (HIF-1α), карбоксиметиллизина (CML), проведены тест с шестиминутной ходьбой и эхокардиографическое исследование с оценкой диастолической функции левого желудочка.
Результаты. Средний уровень NT-proBNP составил 125,8 [109,4; 146,9] пг/мл, галектина-3 — 1,2 [0,9; 1,4] нг/мл, sST2 — 1,5 [0,4; 3,8] нг/мл, HIF-1α — 0,13±0,049 нг/мл, CML — 346,69±50,63 пг/мл. В течение шести месяцев повторно по любой причине госпитализированы 36,3% пациентов, 18,8% из них — по поводу сердечно-сосудистых заболеваний. Методами ROC-анализа и бинарной логистической регрессии выявлены клинические, лабораторные и инструментальные предикторы ранней регоспитализации по сердечно-сосудистой причине: факт такой госпитализации в предшествующие 6 мес., увеличение конечного диастолического размера левого желудочка >5,05 см, систолического давления в легочной артерии >24,5 мм рт.ст., >6,5 баллов по шкале H2FPEF, снижение уровня скорости клубочковой фильтрации <36,97 мл/мин/1,73 м2, индекс коморбидности Чарлсон >5,5 баллов, уровень галектина-3 <1,5 нг/мл. На основании полученных данных разработана модель прогнозирования повторной госпитализации в течение 6 мес. наблюдения, чувствительность которой составила 66,7%, специфичность — 89,1%.
Заключение. Предикторами ранней повторной госпитализации пациентов кардиоренометаболического фенотипа ХСНсФВ являются факт госпитализации по сердечно-сосудистой причине в предшествующие 6 мес., увеличение конечного диастолического размера левого желудочка, систолического давления в легочной артерии, снижение скорости клубочковой фильтрации, индекс коморбидности Чарлсон, уровень галектина-3 и средний балл по шкале H2FPEF.
Цель. Оценить факторы риска развития нарушения проводящей системы сердца и определить их значимость в проведении временной электрокардиостимуляции (вЭКС) и имплантации постоянного кардиостимулятора (пЭКС) у пациентов после хирургического протезирования аортального клапана (АоК) и других сочетанных кардиохирургических вмешательств.
Материал и методы. Проведен анализ пациентов, которым выполнено хирургическое протезирование аортального клапана и другие сочетанные кардиохирургические вмешательств за период с января 2018 г. по май 2023 г. в КГБУЗ «Краевая клиническая больница» г. Красноярск.
Результаты. Определена взаимосвязь между возникновением атриовентрикулярной блокады (АВБ) II-III степени и дисфункцией синусового узла (ДСУ), потребовавшие установки вЭКС и имплантации пЭКС у пациентов после хирургического протезирования АоК и других сочетанных кардиохирургических вмешательств. У 107 (44,6%) пациентов выявлена фибрилляция предсердий, у 8 (3,3%) — блокада левой ножки пучка Гиса (БЛНПГ) и у 8 (3,3%) пациентов блокада правой ножки пучка Гиса (БПНПГ), АВБ I степени — у 12 (5,0%) пациентов. Потребность в установке вЭКС после хирургического протезирования АоК и других сочетанных кардиохирургических вмешательств была у 79 (45,4%) пациентов. 76 (96,2%) пациентам вЭКС проводилась в течение 2 сут. после оперативного лечения и 3 (3,8%) пациентам в течение 72 ч. Согласно однофакторному анализу, были определены 4 важные причины для проведения вЭКС: фибрилляция предсердий (отношение шансов (ОШ)=2,47, 95% доверительный интервал (ДИ)=1,31-4,46, p=0,005), возраст старше 58,5 лет (ОШ=2,52, 95%ДИ=1,29-4,93, p=0,006), скорость клубочковой фильтрации менее 77 мл/мин (ОШ=2,12, 95% ДИ=1,08-4,17, p=0,028) и предсердная тахикардия (ОШ=8,00, 95% ДИ=1,04-67,92, p=0,046). Имплантация пЭКС выполнена 12 (6,7%) пациентам, 11 (91,7%) по причине полной АВБ и 1 (8,3%) пациенту вследствие развития ДСУ. Имплантация пЭКС после кардиохирургических вмешательств была проведена 8 (66,7%) пациентам от 5 до 8 суток, 3 (25,0%) пациентам от 10 до 15 сут. и 1 (8,3%) пациенту через 23 мес. Согласно регрессионному анализу выявлен значимый признак, указывающий на высокий риск имплантации пЭКС — исходное наличие БЛНПГ (ОШ=6,32, 95% ДИ=1,09-36,70, p=0,020).
Заключение. Выявленные факторы риска нарушения проведения после хирургического протезирования АоК и других кардиохирургических вмешательств могут быть использованы для своевременного проведения вЭКС и имплантации пЭКС.
СТРАНИЦЫ НАЦИОНАЛЬНОГО ОБЩЕСТВА ДОКАЗАТЕЛЬНОЙ ФАРМАКОТЕРАПИИ
Цель. Изучить в рамках амбулаторного регистра особенности диагностики и лекарственной терапии начальных нарушений углеводного обмена (предиабета) у пациентов кардиологического профиля.
Материал и методы. Наблюдательное одномоментное (cross-sectional) исследование было выполнено в рамках амбулаторного регистра по изучению нерациональных лекарственных назначений CHIP (CHuvashia Inappropriate Prescribing Study) у пациентов старше 50 лет, обратившихся за консультацией к врачу-кардиологу кардиологического диспансера. По базе регистра проанализированы данные амбулаторного приема кардиолога диспансера, медицинской документации больных. Аналогом термина «предиабет» в карте регистра был диагноз «нарушение толерантности к глюкозе». Приверженность фармакотерапии определялась с помощью шкалы приверженности Национального общества доказательной фармакотерапии.
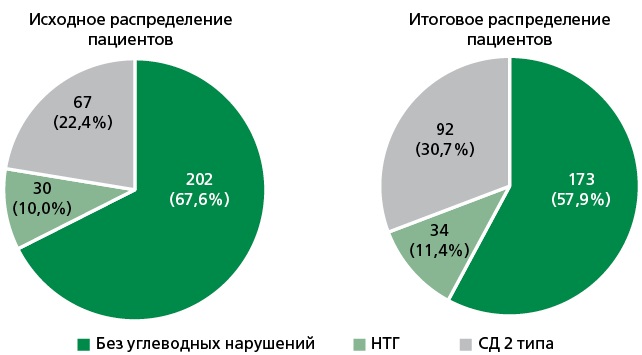
Результаты. В регистр CHIP было включено 300 пациентов: 120 (40%) мужчин и 180 (60%) женщин. Средний возраст пациентов составил 66,4±7,6 лет. Исходно были получены следующие сведения об отсутствии/наличии углеводных нарушений у 300 пациентов регистра: у 202 человек нарушений углеводного обмена не было; у 30 пациентов имелся диагноз нарушение толерантности к глюкозе, у 67 человек — сахарный диабет (СД) 2 типа (СД-2) и у 1 — СД 1 типа (данные этого пациента были исключены из дальнейшего анализа). Наиболее частым тестом для оценки углеводного обмена оказался анализ гликемии натощак (выполнен у 98% больных), у каждого пятого (22,4%) был определен уровень гликированного гемоглобина и лишь у 12 человек (4%) был проведен пероральный глюкозотолерантный тест. Анализ результатов этих тестов показал, что у 17 пациентов, исходно распределенных в подгруппу «без углеводных нарушений», показатель гликемии натощак соответствовал критериям диагностики предиабета, а еще у 12 человек из этой подгруппы и у 13 пациентов с исходным диагнозом «нарушение толерантности к глюкозе» — критериям диагностики СД-2. Согласно итоговым данным, у 173 (57,9%) человек исследуемой когорты углеводных нарушений не было, у 34 (11,4%) пациентов имелся предиабет и у 92 (30,7%) — СД-2. Окружность талии и индекс массы тела были значимо больше в группе пациентов с СД. Также отмечено увеличение частоты сопутствующих заболеваний (артериальной гипертонии, хронической сердечной недостаточности, фибрилляции предсердий, ишемической болезни сердца (р=0,003), в том числе перенесенного инфаркта миокарда) у пациентов с предиабетом и с СД по сравнению с больными без углеводных нарушений. Наибольшее количество неприверженных фармакотерапии больных выявлено в подгруппе без углеводных нарушений, наименьшее — среди пациентов с СД-2. Метформин был назначен каждому пятому пациенту с предиабетом.
Заключение. Продемонстрирована недостаточно полная диагностика нарушений углеводного обмена — предиабета и СД-2 у кардиологических пациентов, редкое назначение метформина для профилактики диабета, что подтверждает важность диагностической настороженности в отношении начальных углеводных нарушений на амбулаторном приеме не только эндокринологов, но и врачей других специальностей.
ОБЗОРЫ
В обзоре отражены современные данные о предиктивном потенциале показателей сосудистой жёсткости (СЖ) в отношении риска развития различных сердечно-сосудистых событий (смертность от сердечно-сосудистых заболеваний, общая смертность, развитие хронической болезни почек и когнитивных нарушений, возникновение ишемической болезни сердца, артериальной гипертензии) и других исходов. В качестве показателей СЖ рассматривается не только скорость пульсовой волны, но и сердечно-лодыжечный васкулярный индекс (cardio-ankle vascular index, CAVI). Показаны его технические, физиологические, клинические и другие преимущества, особенно относительно выполнения скрининга риска раннего развития основных сердечно-сосудистых заболеваний. Накоплен значительный опыт использования этого показателя как для клинического изучения сосудистого статуса у пациентов с явной сердечно-сосудистой патологией, так и для скрининга на популяционном уровне. Проанализированы источники, посвящённые взаимосвязи артериальной гипертензии и повышенной СЖ в аспекте первичности и вторичности этих сдвигов. Подчёркивается особая целесообразность рискометрии с помощью CAVI у лиц молодого возраста по сравнению с пожилым контингентом. Приводятся клинические и доклинические сценарии, при которых измерение СЖ с помощью CAVI может помочь в стратификации риска на самых ранних этапах развития сердечно-сосудистого континуума, которому соответствуют лица молодого возраста. Современные данные указывают, что такая необходимость возникает при наличии изолированной систолической артериальной гипертензии у лиц молодого возраста, прегипертензии у лиц без сахарного диабета и хронической болезни почек, а также при нормотензии на фоне неблагоприятного семейного анамнеза в отношении ишемической болезни сердца. Отражены убедительные результаты российских исследований сосудистого скрининга лиц молодого возраста, нацеленных на повышение у них точности рискометрии, способствующей разработке индивидуализированных программ превентивных вмешательств на ранних этапах сердечно-сосудистой патологии. Результаты таких исследований позволят оптимизировать существующие подходы к борьбе с сердечно-сосудистыми заболеваниями за счёт совершенствования технологий ранней первичной профилактики.
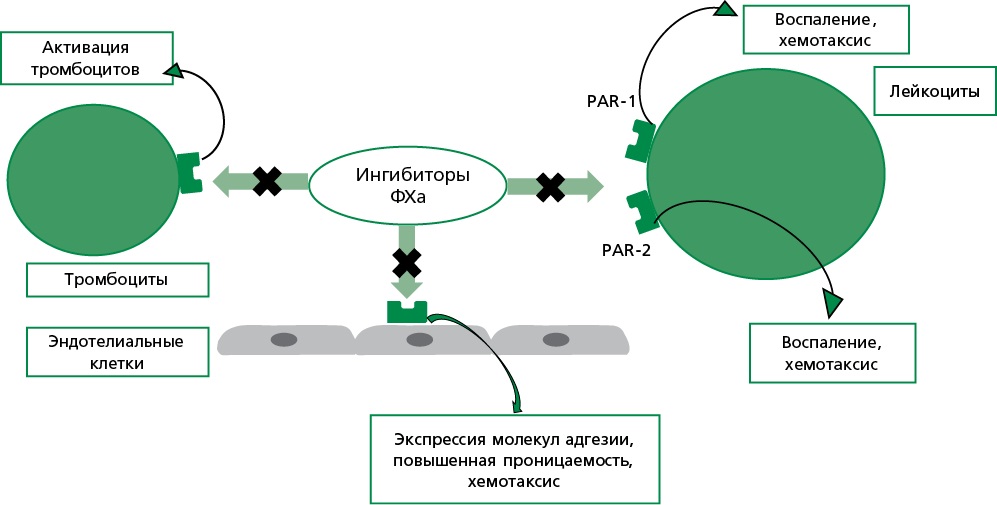
Прямые оральные антикоагулянты (ПОАК), включая ингибиторы фактора Xa (ривароксабан, апиксабан, эдоксабан) и прямой ингибитор тромбина (дабигатран), широко применяются для профилактики и лечения тромботических осложнений, в частности при эндопротезировании крупных суставов, неклапанной фибрилляции предсердий (ФП), а также в составе двойной антитромботической терапии (антикоагулянт + антиагрегант) у пациентов после острого коронарного синдрома и чрескожных коронарных вмешательств, особенно в контексте сопутствующей ФП и повышенного риска системной эмболии. В последние годы значительно усиливается интерес к исследованию плейотропных эффектов ПОАК, выходящих за пределы их основного антикоагулянтного действия. Накапливающиеся экспериментальные и клинические данные свидетельствуют о наличии у этих препаратов дополнительных фармакологических свойств — в частности, противовоспалительного, антиаритмического и нейропротективного действия. Предложенные молекулярные и клеточные механизмы включают снижение уровня провоспалительных цитокинов, модуляцию функций эндотелия, уменьшение выраженности оксидативного стресса, а также положительное влияние на процессы ремоделирования миокарда и нейроваскулярную защиту. Подобные плейотропные эффекты могут играть важную патофизиологическую роль в замедлении прогрессирования сердечно-сосудистых и цереброваскулярных заболеваний, способствуя уменьшению частоты осложнений и улучшая клинические исходы пациентов. Понимание плейотропных свойств ПОАК формирует предпосылки для их более широкого клинического применения в составе комплексной терапии сердечно-сосудистых, воспалительных и цереброваскулярных заболеваний. В настоящем обзоре рассматриваются современные данные о плейотропных свойствах ПОАК и обсуждается их потенциальный вклад в повышение эффективности и индивидуализацию фармакотерапии в клинической кардиологии.
ISSN 2225-3653 (Online)