ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
Цель. Изучить клинические и лабораторно-инструментальные факторы, ассоциированные с развитием феномена невосстановленного коронарного кровотока, у пациентов с инфарктом миокарда в работе кардиологической службы скоропомощного стационара.
Материал и методы. Для проведения исследования была сформирована база данных 2090 пациентов с диагнозом «Острый коронарный синдром», последовательно госпитализированных в региональный сосудистый центр. После проведения чрескожного коронарного вмешательства и оценки коронарного кровотока по шкале TIMI, у 59 пациентов отмечался феномен невосстановленного коронарного кровотока, эти пациенты составили 1-ю группу. 2-я группа (n=149) была сформирована случайным образом из оставшихся 2031 пациентов с финальным коронарным кровотоком TIMI 3. Между группами проводилось сравнение клинико-демографических, лабораторных и инструментальных данных; факторов, влияющих на развитие феномена «no-slow-reflow». Статистическую обработку данных выполняли в программе STATISTICA, с использованием методов параметрического и непараметрического анализа.
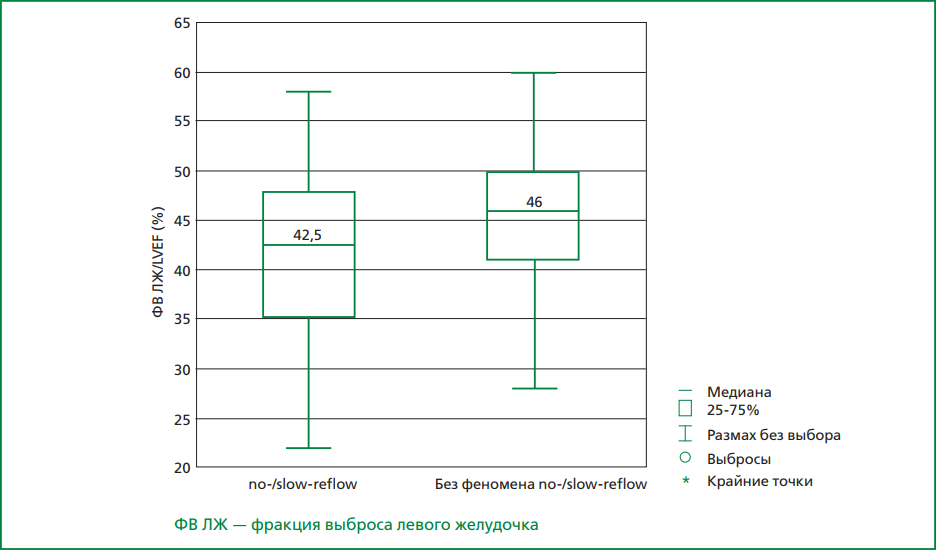
Результаты. В 1-й группе пациентов сахарный диабет встречался с частотой 42,4%, во 2-й — 22,8%, p=0,003. По данным лабораторных исследований у пациентов 1-й и 2-й групп средний уровень лейкоцитов крови составил 10,9×109/л и 9,5×109/л, соответственно, p=0,0015; абсолютное содержание нейтрофилов 8,4×109/л и 6,6×109/л, p=0,0003. В 1-й и 2-й группах пациентов фракция выброса (ФВ) левого желудочка (ЛЖ) составила в среднем 42% и 45% соответственно, p=0,0015. В 1-й группе выявлялись изменения по передней стенке ЛЖ на электрокардиограмме в 59% случаев, во 2-й — в 50%, p=0,018. Проксимальное поражение инфаркт-связанной артерии в 1-й группе наблюдалось в 88%, во 2-й — в 40%, p<0,0001. По данным бинарной логистической регрессии независимыми факторами риска развития феномена «no-/slow-reflow» являются: уровень поражения инфаркт-связанной артерии [OR=3,33; 95% CI: 1,67-6,57; p<0,001], ФВ ЛЖ [OR=1,1; 95% CI: 1,04-1,17; p<0,001], время от начала болевого синдрома до реваскуляризации [OR=1,03; 95% CI: 0,95-0,996; p=0,02].
Заключение. Длительное общее время ишемии миокарда, наличие сахарного диабета, более низкая ФВ ЛЖ, повышенное содержание лейкоцитов и нейтрофилов крови, передняя локализация инфаркта миокарда, более проксимальный уровень окклюзии коронарной артерии, ассоциированы с развитием «no-/slow-reflow» у пациентов с инфарктом миокарда в реальной клинической практике.
Цель. Изучить новые возможности эхокардиографической технологии speckle tracking для выявления субклинической кардиотоксичности химио- и таргетной терапии
Материал и методы. В проспективное обсервационное исследование на кафедре госпитальной терапии №1 ФГБОУ ВО «Российский университет медицины» Минздрава России в 2021-2023 гг. было включено 150 пациентов с верифицированным онкологическим диагнозом и с очень высоким и высоким риском кардиотоксичности, определенным по шкале клиники Мауо. Всем включенным в исследование пациентам за 5-7 дней до начала химио-таргетной терапии был рекомендован прием фиксированной комбинации ингибитора ангиотензинпревращающего фермента (иАПФ) периндоприла и β-адреноблокатора бисопролола (5+5 мг), а пациентам очень высокого риска кардиотоксичности, у которых была выявлена хроническая сердечная недостаточность (ХСН) ишемического генеза или стабильная ишемическая болезнь сердца, либо постинфарктный кардиосклероз, дополнительно был рекомендован прием триметазидина ОД с пролонгированным высвобождением в дозе 80 мг 1 раз в сутки. На втором визите были сформированы основная группа (n=84, получающие кардиопротективные препараты) и группа сравнения (n=66, не принимающие кардиопротективные препараты). Всем пациентам при включении в исследование, а также через 1, 3, 6, 9 и 12 мес. после начала противоопухолевой терапии, помимо сбора жалоб, данных анамнеза, физикального обследования, регистрации электрокардиограммы в 12 стандартных отведениях проводилась двухмерная эхокардиография с определением глобальной продольной систолической деформации (ГПСД) левого желудочка (ЛЖ).
Результаты. Проведение онкологическим больным высокого и очень высокого риска кардиотоксичности первичной медикаментозной профилактики сопровождалось снижением частоты значимых сердечно-сосудистых осложнений в 2,7 раза. Развитие ХСН в основной группе было отмечено в 7 раз реже относительно группы сравнения (n=1 (1,2%) vs n=7 (10,6%), р<0,05), снижение ГПСД ЛЖ — в 2,6 раз (n=5 (5,9%) vs n=13 (19,7%), р<0,05). В процессе наблюдения онкологических больных, получающих химио- и таргетную терапию, при визуальной оценке продольной деформации ЛЖ у пациентов с развившейся систолической дисфункцией выявлялся специфичный паттерн, ранее не описанный в литературе. Отмечалось снижение сократимости во всех базальных сегментах ЛЖ, визуально отображаемое более бледной или даже синей окраской по окружности диаграммы, с наличием компенсаторного гиперкинеза верхушечных сегментов ЛЖ. Снижение деформации ЛЖ в базальных сегментах по окружности наружной части полярной диаграммы >-18%, компенсаторный гиперкинез сократимости верхушечных сегментов ЛЖ <-18% во внутренней части диаграммы по сравнению с исходно определенными значениями продольной деформации ЛЖ до начала противоопухолевой терапии является дополнительным ранним, доклиническим признаком кардиотоксичности.
Заключение. Обнаружение типичных изменений локальной продольной систолической деформации ЛЖ необходимо расценивать как ранний признак кардиотоксичности с последующим изменением лечебной тактики: временной или постоянной отмены химиопрепарата, ставшего причиной развития сердечно-сосудистых осложнений, назначение кардиопротективной терапии иАПФ, β-адреноблокаторами и миокардиальным цитопротектором.
Цель. Проанализировать динамику назначения тройной антитромботической терапии (TATT) при выписке (ТАТТ: оральный антикоагулянт (ОАК) + два антиагреганта) у пациентов с фибрилляцией предсердий (ФП) и острым инфарктом миокарда (ИМ) в 2016-2023 гг., а также соответствие клинической практики клиническим рекомендациям (КР) Европейского общества кардиологов (ЕОК) и Российского кардиологического общества (РКО), одобренным научно-практическим советом Минздрава Российской Федерации .
Материал и методы. Ретроспективно изучены данные 813 пациентов с ФП и острым ИМ, разделенных на четыре группы по времени госпитализации: 2016-2017 гг. (n=104), 2018-2019 гг. (n=256), 2020–2021 гг. (n=239), 2022-2023 гг. (n=214). Проанализированы частота назначения и состав ААТ, а также соответствие ее актуальным КР. В связи с отсутствием КР РКО до 2020 г. проводилась оценка соответствия АТТ КР ЕОК по острому коронарному синдрому без подъема сегмента ST (ОКСбпST) 2015 г. и с подъемом сегмента ST электрокардиограммы 2017 г., а также по ФП 2016 г. После 2020 г. оценивалось соответствие АТТ КР РКО 2020 г. по тем же нозологиям.
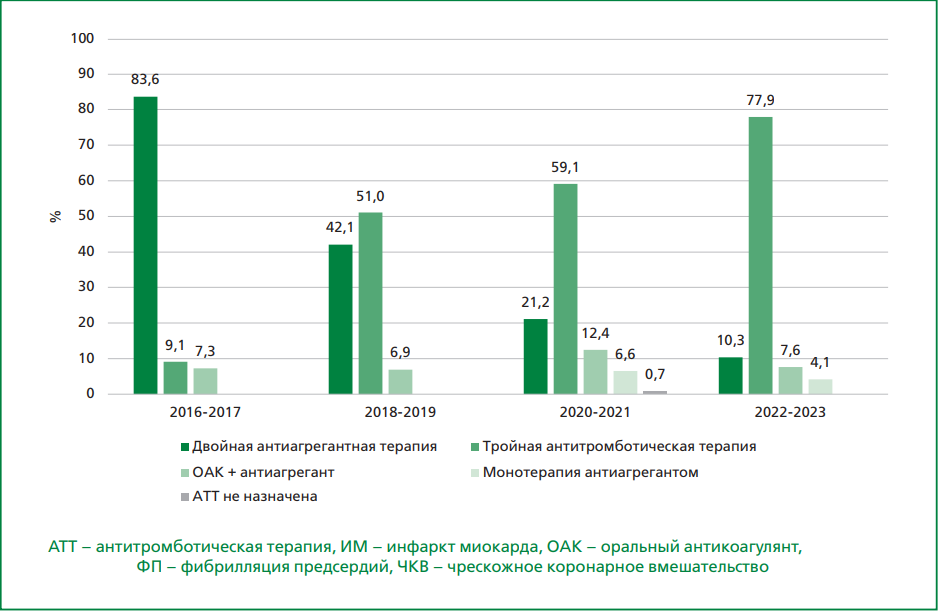
Результаты. ОАК и антиагрегант в 2016-2017 гг. были назначены 10,2%, а 2018-2019 гг. — 13,5% включенных пациентов, не подвергнутых чрескожному коронарному вмешательству (ЧКВ), что соответствовало КР ЕОК по ФП 2016 г. Среди пациентов, подвергнутых ЧКВ, ТАТТ была назначена в 2016-2017 гг. в 9,1% случаев, а в 2018-2019 гг. — в 51,0%, что также соответствовало действующим КР ЕОК. Среди пациентов, не подвергнутых ЧКВ, корректная комбинация ОАК и антиагреганта была назначена 17,2% пациентов в 2020-2021 гг. и 27,5% пациентов в 2022-2023 гг. ТАТТ при выписке была назначена 48,7% пациентам с ОКСбпST, подвергнутым ЧКВ, в 2020-2021 гг. и 72,5% — в 2022-2023 гг., что не противоречило КР РКО 2020 г. по ОКСбпST. Сочетание ОАК и антиагреганта пациентам с ИМ с подъемом сегмента ST, подвергнутым ЧКВ, было назначено в 13,3% случаев в 2020-2021 гг. и в 8,6% — в 2022-2023 гг., что соответствовало КР РКО 2020 г. по ИМ с подъемом сегмента ST. В целом применение ОАК выросло с 16,3% в 2016-2017 гг. до 87,9% в 2022-2023 гг.
Заключение. Исследование демонстрирует значительный прогресс в назначении ОАК и ТАТТ, однако сохраняется разрыв между практикой и КР, особенно в составе применяемой комбинированной АТТ терапии при выписке.
СТРАНИЦЫ НАЦИОНАЛЬНОГО ОБЩЕСТВА ДОКАЗАТЕЛЬНОЙ ФАРМАКОТЕРАПИИ
Цель. Оценить реальную практику использования инвазивных методов диагностики и лечения у больных с острым коронарным синдромом без подъема сегмента ST(ОКСбпST) в рамках регистра регионального сосудистого центра.
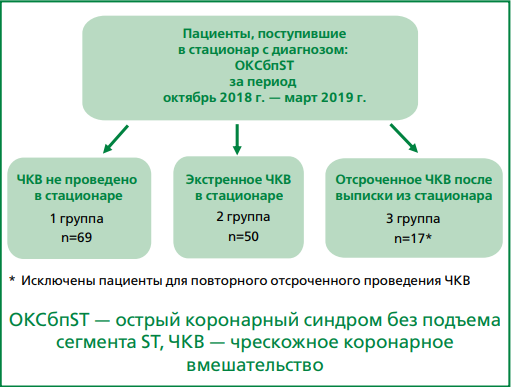
Материал и методы. В исследование включены 136 пациентов, последовательно поступавших в сосудистый центр г. Сергиева Посада в экстренном порядке с октября 2018 г. по март 2019 г., с диагнозом ОКСбпST. Средний возраст составил 63±11 года, доля мужчин — 61%.
Результаты. Всем пациентам была выполнена коронарная ангиография (КАГ) в ближайшие сроки после поступления в стационар (<2 ч). Ни у одного из больных не выявлено абсолютных противопоказаний для проведения чрескожного коронарного вмешательства (ЧКВ). Все 136 пациентов в зависимости от выбранной тактики инвазивного лечения были разделены на 3 группы: пациенты, которым не было проведено ЧКВ на стационарном этапе лечения и при отдаленном наблюдении — 69 человек (50,7%; 1-я группа); пациенты, которым проведено ЧКВ во время текущей госпитализации — 50 человек (36,8%; 2-я группа); пациенты, которым проведено отсроченное ЧКВ после текущей госпитализации — 17 человек (12,5%; 3-я группа). На принятие решения о проведении ЧКВ не влияли клиническая картина заболевания и риск по шкале GRACE. У больных 3-й группы трехсосудистое поражение коронарных артерий (КА) по результатам КАГ встречалось существенно чаще, чем в 1 и 2 группах (59% vs 22% и 34%, р=0,001). Согласно результатам регрессионного анализа выявление поражения только одной КА многократно повышало вероятность выполнения ЧКВ. Эта вероятность прогрессивно уменьшалась по мере увеличения степени поражения КА.
Заключение. В региональном сосудистом центре у пациентов с диагнозом ОКСбпST ЧКВ в стационаре была проведена лишь 36% больных. При решении вопроса о проведении ЧКВ в первую очередь врачи руководствовались не столько степенью риска сердечно-сосудистых осложнений, как того требуют клинические рекомендации, сколько техническими возможностями процедуры и ее безопасностью.
АКТУАЛЬНЫЕ ВОПРОСЫ КЛИНИЧЕСКОЙ ФАРМАКОЛОГИИ
В статье рассмотрены результаты рандомизированных контролируемых и некоторых наблюдательных исследований, определивших современные представления о роли ривароксабана в профилактике кардиоэмболических осложнений у больных с фибрилляцией предсердий (ФП). Согласно результатам рандомизированного контролируемого исследования ROCKET AF у больных с неклапанной ФП ривароксабан как минимум не уступает по эффективности варфарину. При этом при сопоставимой частоте крупных и клинически значимых некрупных кровотечений в группе ривароксабана реже отмечались смертельные кровотечения и кровотечения c наиболее тяжелыми последствиями (включая внутричерепные) и чаще — клинически значимые желудочно-кишечные кровотечения. В целом частота крупных желудочно-кишечных кровотечений увеличивалась в группе ривароксабана на 10 случаев на каждую 1000 леченых в год и их возникновение не приводило к необходимости переливания больших объемов крови или увеличению риска смертельного исхода. Аналогичных клинических эффектов можно ожидать у различных категорий пациентов, включая больных с нарушенной функцией почек (вплоть до клиренса креатинина 15 мл/мин), больных пожилого и старческого возраста. Согласно накопленным фактам ривароксабан позволяет уменьшить риск коронарного тромбоза после коронарного стентирования и в этом случае должен сочетаться с одним антиагрегантом (в основном с клопидогрелом). Согласно результатам исследования X-VERT при кардиоверсии ривароксабан представляется эффективной и безопасной альтернативой антагонистам витамина К и может позволить быстро выполнить кардиоверсию у гемодинамически стабильных больных с пароксизмом неклапанной ФП. Из-за отсутствия доступного метода лабораторного контроля и больших различий концентрации препарата в крови у получающих ривароксабан для его дженериков особое значение приобретают исследования биоэквивалентности с определением анти-Ха активности в крови. Данные о сходном составе таблеток, сопоставимой кинетике растворения и биоэквивалентности есть, в частности, у российского дженерика ривароксабана Зинакорен.
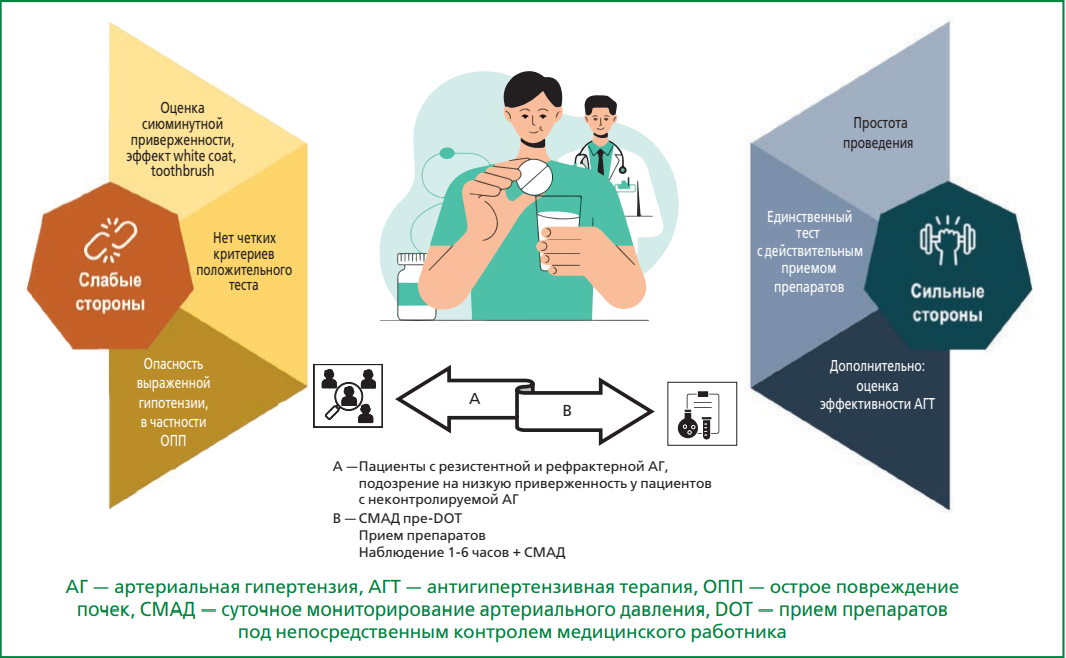
Низкая приверженность к терапии – одна из основных причин псевдорезистентной артериальной гипертензии (АГ), сопряжена с повышением риска сердечно-сосудистых осложнений и увеличением прямых и непрямых медицинских затрат. Оценка приверженности является важным элементом в ведении пациентов с неконтролируемой АГ, особенно при подозрении на устойчивость к терапии. «Золотого стандарта» оценки приверженности к терапии нет и поэтому, кроме непрямых методов, хотя и простых, но довольно ненадежных, в последнее время все чаще используются прямые способы — контроль приема препаратов в присутствии медперсонала, которые проводятся на фоне повторного мониторирования артериального давления при помощи портативных устройств или повторных его измерений специалистом, а также терапевтический мониторинг лекарственных препаратов или метаболитов в биологических жидкостях с использованием ультра-высокоэффективной жидкостной хроматографии с тандемной масс-спектрометрией. В данном описательном обзоре представлены ключевые результаты исследований по применению этих методов, рассмотрены их ограничения и преимущества, а также даны практические рекомендации по внедрению этих подходов в повседневную клиническую практику. Симультанное и как можно более раннее их применение позволяет исключить в ряде случаев необходимость в дополнительных сложных и затратных лечебно-диагностических процедурах, а также более точно и надежно выделить группу пациентов с истинно резистентной АГ — когорту, которая представляет наибольший научно-практический интерес. Использование рассмотренных подходов повышает клинико-экономическую эффективность лечения, помогает выявить парамедицинские проблемы и укрепляет взаимодействие между врачом и пациентом.
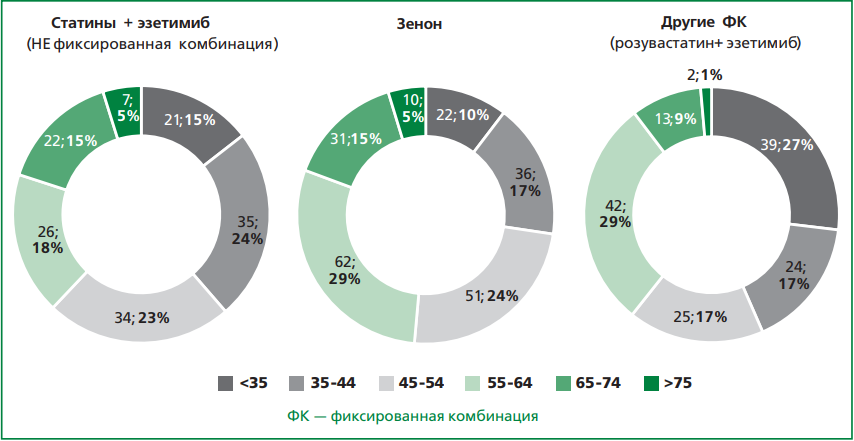
Цель. Изучить адекватность и эффективность назначаемой пациентам с гетерозиготной семейной гиперхолестеринемией (геСГХС) гиполипидемической терапии (ГЛТ), включая фиксированные комбинации (ФК) розувастатина с эзетимибом, а также оценить частоту достижения целевого уровня холестерина липопротеидов низкой плотности (ХС ЛНП).
Материал и методы. Проведен ретроспективный анализ клинико-демографических данных 3151 пациентов с геСГХС из регистра РЕНЕССАНС, относящихся к категории высокого/очень высокого сердечно-сосудистого риска. Из 1612 человек, получавших ГЛТ, 477 пациентов принимали сочетание розувастатина в различных дозировках с эзетимибом 10 мг в сутки, как в виде свободной комбинации, так и в виде ФК розувастатина с эзетимибом.
Результаты. Медиана возраста пациентов составила 46,0 [32,0; 57,0] лет. Медиана уровня ХС ЛНП — 6,4 [5,3; 7,8] ммоль/л. Всем пациентам была рекомендована ГЛТ, однако почти половина (49%, n=1539) ее не принимала. Среди 1612 пациентов, принимавших ГЛТ, 703 человека (44%) находились на монотерапии статинами, 697 (43%) — на комбинированной терапии статинами и эзетимибом. Из 477 пациентов, получавших комбинацию розувастатина с эзетимибом, статистически значимо большая часть относилась к активному и трудоспособному возрасту (35-64 года): 335 (80%) vs 86 (20%), p <0,05. Большинство пациентов предпочло ФК розувастатина и эзетимиба: 357 (74,8%) vs 120 (25,2%) на свободной комбинации, p <0,05. Среди пациентов на ФК значимо большее число лиц предпочло прием препарата Зенон® по сравнению с другими ФК: 212 (44,4%) vs 145 (30,4%), p <0,05. На фоне терапии зафиксировано снижение уровня ХС ЛНП по сравнению с исходными значениями: на 61% в группе свободной комбинации и на 65% в группе ФК, включая снижение на 67% в подгруппе, получавшей Зенон® (p <0,001). Частота достижения целевого уровня ХС ЛНП у пациентов с высоким/очень высоким сердечно-сосудистым риском с геСГХС была статистически значимо ниже в группе свободной комбинации по сравнению с ФК, особенно при применении препарата Зенон®: 5,8% (n=7), 17,9% (n=26) и 21,7% (n=46), соответственно, p <0,01.
Заключение. Применение ФК розувастатина и эзетимиба у пациентов с геСГХС способствует повышению приверженности терапии и более высокой частоте достижения целевых уровней ХС ЛНП.
СМЕЖНЫЕ ВОПРОСЫ КАРДИОЛОГИИ
Цель. Изучить показатели вариабельности сердечного ритма (ВСР) у больных системной склеродермией (ССД) и их взаимосвязь с характеристиками заболевания и проводимой терапией.
Материал и методы. В исследование включены 48 больных ССД и 43 здоровых лица. Проводили определение ВСР по данным электрокардиограммы (ЭКГ), записанной в покое при спокойном дыхании (5-мин фрагмент) и по данным суточного мониторирования ЭКГ (амбулаторно).
Результаты. По данным 5-мин записей ЭКГ у больных ССД по сравнению с контрольной группой выявлены повышение частоты сердечных сокращений (ЧСС) (p=0,023) и изменения частотных параметров ВСР: снижение показателей HFlog и HFn.u. (p=0,046 и p=0,027 соответственно), повышение показателя LF (p=0,018) и отношения LF/HF (p=0,016). По данным суточного мониторирования ЭКГ у больных ССД наблюдаются повышение ЧСС, снижение SDNNidx и pNN50 за весь период записи и в дневное время, статистически значимое снижение большинства параметров ВСР (meanNN, SDNN, SDNNidx, rMSSD и pNN50) в ночное время. По данным 5-мин записей ЭКГ выявлена взаимосвязь между показателями ЧСС (meanRR и meanHR) и длительностью синдрома Рейно (R=0,31, p=0,034; R=-0,30, p=0,043). При наличии поражения сердца в анамнезе у больных ССД по данным суточного мониторирования отмечались более низкие показатели SDNNidxall, SDNNidxday, SDNNidxnight, pNN50night; по данным 5-мин записей ЭКГ — более низкие значения total power, LFмс2, LFlog, SD2. При наличии поражения легких отмечается более высокая ЧСС по показателям meanRR, meanHR и meanNNday (по данным 5-мин и суточных записей ЭКГ). Выявлены корреляции между уровнем С-реактивного белка и нелинейными параметрами ВСР (по данным 5-мин записей ЭКГ) SD2/SD1 (R=-0,419, p=0,015) и DFAα1 (R=-0,419, p=0,015). У больных ССД, принимающих блокаторы медленных кальциевых каналов, отмечаются более высокие значения временных параметров ВСР по данным суточного мониторирования ЭКГ (p<0,05).
Заключение. У больных ССД наблюдаются снижение частотных, временных и нелинейных показателей ВСР по данным коротких и суточных записей ЭКГ. Выявлена потенциально неблагоприятная взаимосвязь нелинейных показателей ВСР и концентрации С-реактивного белка, а также корреляции ЧСС с длительностью синдрома Рейно и ВСР — с поражением легких и сердца. Терапия блокаторами медленных кальциевых каналов ассоциирована с улучшением циркадного ритма ВСР.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Цель. Оценить безопасность и эффективность неиммуногенной стафилокиназы у пациента с массивной тромбоэмболией легочной артерии (ТЭЛА) высокого риска на фоне субдуральной гематомы.
Материал и методы. Неиммуногенная стафилокиназа (Фортелизин®, ООО «СупраГен», Россия) — оригинальный лекарственный препарат с высокой фибринселективностью и минимальным риском развития кровотечений. Описан клинический случай тромболитической терапии неиммуногенной стафилокиназой в дозе 15 мг однократно болюсно у пожилого пациента с массивной ТЭЛА высокого риска на фоне субдуральной гематомы.
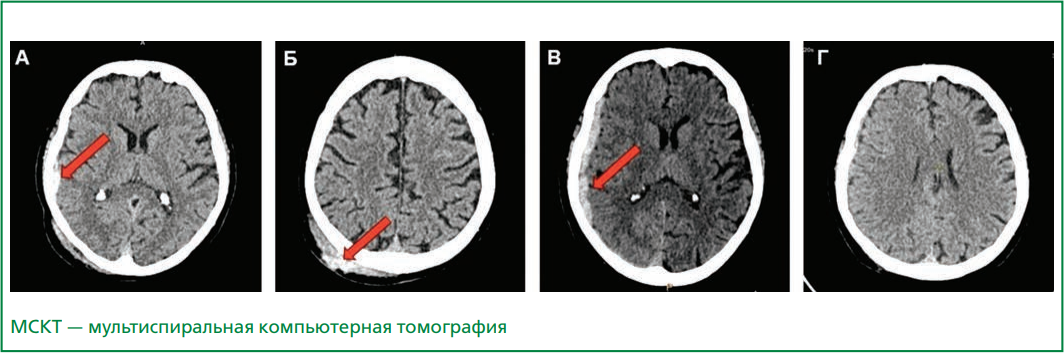
Результаты. У пациентки 85 лет с массивной ТЭЛА очень высокого риска смертности (V класс по PESI) на фоне острой субдуральной пластинчатой гематомы справа, полученной вследствие закрытой черепно-мозговой травмы, проведена тромболитическая терапия неиммуногенной стафилокиназой. Уже в первые сутки отмечена положительная динамика в виде снижения одышки, повышения сатурации с 74% до 97%, снижения систолического давления в легочной артерии с 60 до 31 мм рт.ст., уменьшения признаков дисфункции правого желудочка. По данным мультиспиральной компьютерной томографии головного мозга, в первые сутки после тромболизиса имело место нарастание объема субдуральной гематомы (максимальная толщина 8 мм) без дислокационного синдрома и без очагового неврологического дефицита. Через неделю пациентка была выписана. При осмотре через 4 мес. отмечен регресс субдуральной гематомы: нитевидное уплотнение толщиной <2 мм. Использование неиммуногенной стафилокиназы не привело к развитию больших кровотечений и геморрагического инсульта.
Заключение. Неиммуногенная стафилокиназа показала высокую безопасность и эффективность в лечении массивной ТЭЛА у пожилого пациента с высоким риском геморрагических осложнений на фоне субдуральной гематомы.
ТОЧКА ЗРЕНИЯ
В настоящее время ведение пациента с митральной регургитацией (МР) представляет собой трудную задачу. Среди основных причин МР выделяют дегенеративные и ишемические в развитых странах и ревматические изменения створок – в развивающихся странах. Прогрессирование МР происходит постепенно и часто незаметно, что связано с компенсаторными механизмами сердца, и приводит к ремоделированию левого желудочка и ухудшению прогноза. Клиническое улучшение состояния пациента с острой МР после появления признаков сердечной недостаточности, очевидно, обусловлено постепенным увеличением левого предсердия и снижением предсердного давления. Первичная оценка МР предполагает наличие клинических симптомов сердечной недостаточности, которые развиваются по мере увеличения объема МР и усугубления систолической дисфункции левого желудочка. Вместе с тем, этих данных недостаточно для определения показаний к хирургическому вмешательству. Для количественной оценки тяжести порока следует использовать эхокардиографические методы. Единственным методом лечения, который доказано улучшает симптомы и предотвращает сердечную недостаточность, является хирургический. Ежегодные показатели смертности при оперативном лечении пациентов в возрасте 50 лет и старше составляет около 3% для умеренной и 6% для тяжелой МР. Клапан сохраняющие операции превосходят по результату протезирование и снижают смертность у пациентов с тяжелой органической МР на 70%. Критическое значение для успеха операции имеет морфология поражения клапанного аппарата. Последствия выраженного ревматического поражения клапана ограничивают возможность реконструкции. При невозможности выполнения пластики предпочтительно проведение протезирования клапана с сохранением подклапанного аппарата. Наилучшие краткосрочные и отдаленные результаты оперативного лечения получены у бессимптомных пациентов, оперированных в специализированных центрах. Это подчеркивает важность раннего выявления и оценки МР.
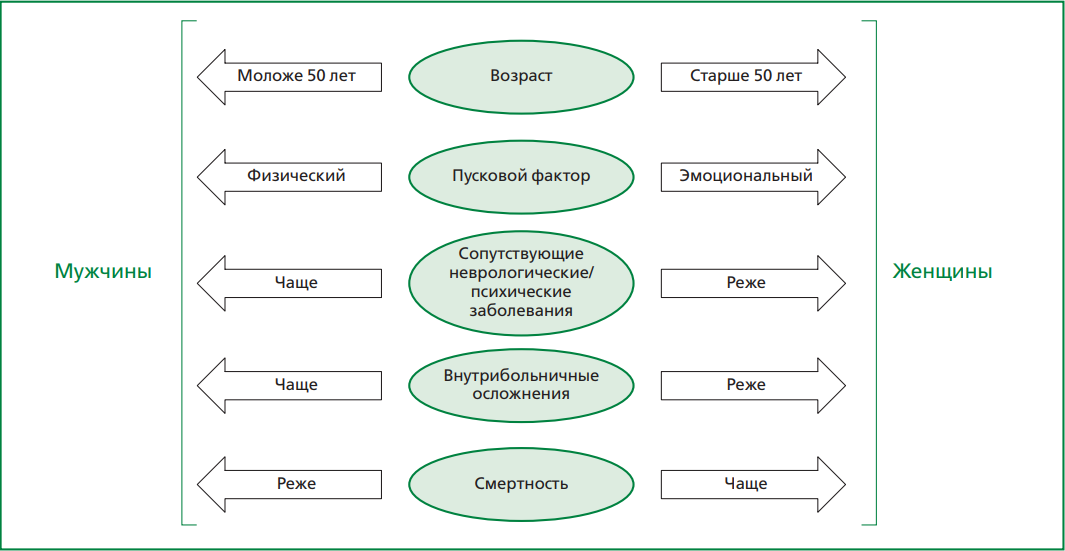
В последние годы наблюдается повышенный интерес исследователей к изучению синдрома такоцубо (СТ), представляющего собой особую форму обратимой дисфункции миокарда левого желудочка, а в редких случаях — правого желудочка. Известно, что данная патология преимущественно встречается у женщин в постменопаузе и в большинстве случаев провоцируется перенесенным физическим и/или эмоциональным стрессом. Вместе с тем патофизиология СТ до конца не изучена, в настоящее время ключевое значение отводится всплеску катехоламинов и активации симпатической нервной системы. Ввиду того, что по клинической и электрокардиографической картинам, а также профилю кардиоспецифичных маркеров СТ схож с острым коронарным синдромом, проведение дифференциальной диагностики между этими двумя состояниями является задачей, требующей от врача высокой степени ответственности. Кроме того, несмотря на обратимый характер изменений, наблюдаемых при СТ, заболевание ассоциировано с высоким риском развития как серьезных внутрибольничных, так и отдаленных осложнений. Основным методом визуализации, позволяющим выявить характерную форму акинезии или дискинезии верхушки левого желудочка, а также исключить другие причины острой сердечной недостаточности является эхокардиография. Вместе с тем немаловажное значение в диагностике СТ отводится коронарной ангиографии, при которой ключевым признаком служит отсутствие обструктивного поражения коронарных артерий, и магнитно-резонансной томографии сердца, позволяющей оценить степень отека миокарда, наличие фиброза и другие структурные изменения. Таким образом, использование мультимодального подхода к визуализации существенно повышает надежность постановки диагноза и позволяет своевременно оценить вероятный прогноз у больных с СТ. Цель обзора — представить актуальную информацию об этиологии, клинических особенностях СТ, а также рассмотреть современные представления о диагностике данной патологии.
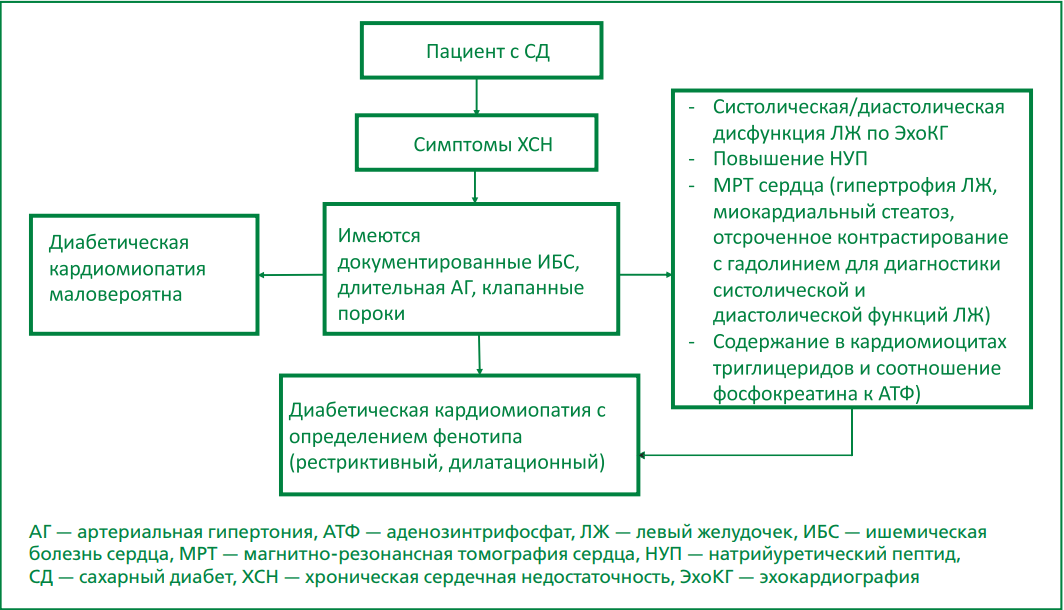
Начиная с 70-х годов прошлого столетия предметом изучения специалистов и ученых является специфическое нарушение структуры и функции миокарда при сахарном диабете (СД) — диабетическая кардиомиопатия (ДК), основным клиническим проявлением которой является сердечная недостаточность (СН). Многочисленные исследования демонстрируют высокий риск развития СН у больных сахарным диабетом 2 типа (СД2), а также ухудшение прогноза вышеуказанных заболеваний при сопряженном течении. Так, в популяционном исследовании Kaiser Permanente у пациентов с СД2 моложе 75 лет риск СН был в 3-4 раза выше, чем у пациентов без диабета. Несмотря на накопленный опыт в изучении патологии, ДК множеством специалистов рассматривается как осложнение СД, а не как отдельное состояние, и является предметом споров и дискуссий. В то же время, проводимые исследования все чаще выявляют характерные нарушения функции сердца с особенностями патофизиологии, что дает основание говорить о, возможно, отдельном состоянии, протекающем на фоне СД. К настоящему времени нет общепринятых клинических руководств по диагностике и лечению ДК, в связи с чем существует потребность определения четких и ясных диагностических критериев ДК, что жизненно важно для выявления групп высокого риска развития данной кардиомиопатии. В обзорной статье анализируются данные литературы по изучаемой проблеме, касающиеся терминологии, этиологии, патогенеза и лечения. Систематизация имеющихся знаний, четкая формулировка критериев постановки диагноза позволили бы больше сосредоточиться на поиске новых терапевтических методов.
ISSN 2225-3653 (Online)