ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
Цель. Изучить цитокиновый профиль макрофагов в тканях клапанов у оперированных пациентов с инфекционным эндокардитом (ИЭ), его связи с маркерами воспаления для оптимизации оценки активности ИЭ.
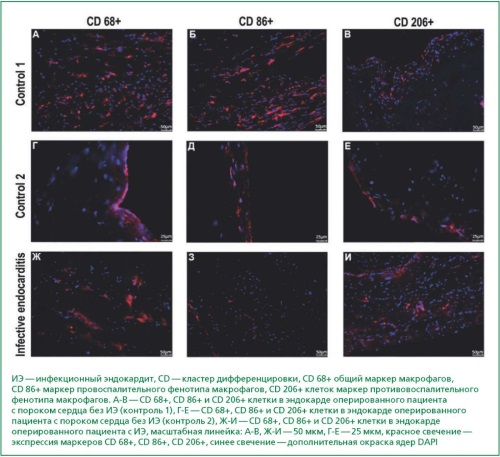
Материал и методы. В проспективное исследование включены 25 взрослых пациентов с активным ИЭ (критерии Duke 2015 г.) и 24 пациента с пороками сердца без ИЭ, госпитализированных для кардиохирургического лечения (2021-2022 гг.). Выполнено лабораторно- инструментальное обследование, включая верификацию возбудителя, в том числе методом полимеразной цепной реакции (ПЦР) Real Time в крови/тканях резецированных клапанов, эхокардиографическое исследование и оценку нейтрофильно- лимфоцитарного индекса. В тканях клапанов проводилось исследование фенотипических признаков макрофагов методом иммуногистохимии и оценка экспрессии генов про- и противовоспалительных цитокинов методом ПЦР Real Time.
Результаты. У пациентов с ИЭ имелась высокая доля вторичных форм ИЭ за счёт дегенеративных пороков сердца (n = 10, 40,0 %) и левосторонней локализации ИЭ (n = 16, 64,0 %). Методом иммуногистохимии выявлено преобладание неповрежденных макрофагов провоспалительного фенотипа CD 86+ у пациентов без ИЭ по сравнению с пациентами с ИЭ (0,054 (0,029-0,073) vs 0,008 (0,0071-0,0096), p < 0,05). В отношении противовоспалительного фенотипа макрофагов CD 206+ статистически значимой разницы не получено. В группе оперированных пациентов с ИЭ методом ПЦР Real Time выявлена значимая экспрессия генов ИЛ-1β (Ме (интерквартильный размах (IQR)) 0,0037 (0,0005-0,0155) vs 0,0002 (0,0001-0,0026), p < 0,05) и ИЛ-6 (Ме (IQR) 0,0034 (0,0007-0,0167) vs 0,0005 (0,0004-0,0038), p < 0,05) по сравнению с пациентами без ИЭ. В отношении противовоспалительных цитокинов статистически значимых различий не получено. Уровень экспрессии генов цитокинов тканевыми макрофагами в зависимости от наличия эмболических событий, этиологической принадлежности к S. aureus, а также госпитальной летальности и комбинированной конечной точки (смерть от всех причин или рецидив ИЭ через 6 мес. после операции) не различался между пациентами с ИЭ с эмболическими событиями или без них. Уровень ИЛ-1β имел наиболее благоприятные характеристики для оценки активности ИЭ (площадь под ROC-кривой 0,816 (p = 0,02)).
Заключение. Повышенная деструкция макрофагов с избыточным выходом провоспалительных цитокинов в ткани клапанов определяет неконтролируемое течение ИЭ и потребность в кардиохирургическом лечении. ИЛ-1β обладает высокой диагностической ценностью определения активности воспаления у оперированных пациентов с ИЭ.
Цель. Выяснить знания врачей и их представления о терапии, влияющей на прогноз пациентов с хронической сердечной недостаточностью со сниженной фракцией выброса левого желудочка (ХСНнФВ).
Материал и методы. Проведено анонимное анкетирование 207 врачей (155 кардиологов, 44 терапевтов, 8 врачей других специальностей), обучавшихся по программам повышения квалификации весной 2023 г. Анкета включала вопросы, отражающие представления врачей о терапии, направленной на снижение риска госпитализации из-за сердечной недостаточности и смерти пациентов с ХСНнФВ.
Результаты. Оптимальным вариантом лечения ХСНнФВ 63,3 % опрошенных врачей (71,6 % кардиологов и 36,4 % терапевтов) назвали квадротерапию: сакубитрил-валсартан (ангиотензиновых рецепторов и неприлизина ингибитор, АРНИ) или ингибитор ангиотензинпревращающего фермента/блокатор рецепторов ангиотензина II + бета-адреноблокатор (БАБ) + антагонист минералкортикоидных рецепторов (АМКР) + ингибитор натрий- глюкозного котранспортера 2 типа (ИНГТ2). Верно указали показания к назначению АРНИ 80 % респондентов (89 % кардиологов и 50 % терапевтов), показания к терапии БАБ — 75,4 % (83,9 % кардиологов и 45,4 % терапевтов), показания к назначению АМКР — 71,0 % (80 % кардиологов и 36,3 % терапевтов), показания к применению ИНГТ2 — 76,8 % (86,4 % кардиологов и 43,1 % терапевтов). Правильно назвали критерии достижения целевой дозы БАБ 81,7 % респондентов (89,7 % кардиологов и 52,3 % терапевтов), нейромодулирующую дозу АМКР — 45,9 % врачей (51 % кардиологов и 31,8 % терапевтов), рекомендованную дозу дапаглифлозина — 74,3 % респондентов (83,9 % кардиологов и 52,3 % терапевтов). Для всех сравнений между группами кардиологов и терапевтов p < 0,01. Среди препаратов, которые наиболее часто применяют для улучшения прогноза пациентов с ХСНнФВ II-IV функционального класса в собственной практике, респонденты указали БАБ (66,2 %), АМКР (58,5 %), ингибитор ангиотензинпревращающего фермента /блокатор рецепторов ангиотензина II (57 %), АРНИ (37,7 %), ИНГТ2 (45,4 %). Кардиологи чаще, чем терапевты, применяют АРНИ (р < 0,01), ИНГКТ2 (р < 0,01), АМКР (р < 0,05).
Заключение. Результаты исследования показали недостаточное знание врачами, особенно терапевтами, ключевых положений клинических рекомендаций по фармакотерапии ХСНнФВ, что может быть одной из причин субоптимального лечения пациентов с этой патологией.
Цель. Выявить основные социально-демографические, психологические, гемодинамические и метеорологические предикторы повышения артериального давления (АД) в холодный сезон у пациентов Московского региона со стабильной артериальной гипертонией (АГ).
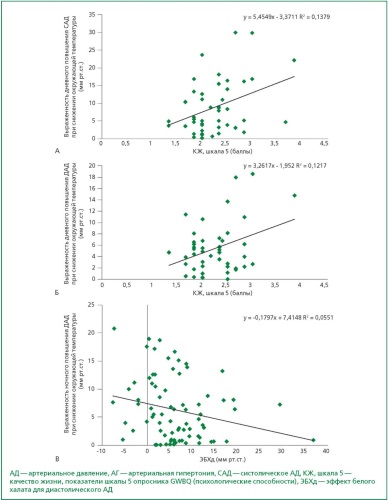
Материал и методы. В исследовании, проведенном в Национальном медицинском исследовательском центре терапии и профилактической медицины с 1997 по 2009 гг., приняли участие пациенты с АГ без тяжелых сопутствующих заболеваний, требующих регулярной терапии. На первом и втором визитах пациенты заполняли анкеты, которые оценивали их психологический статус (ПС) и качество жизни (КЖ), затем проводилось суточное мониторирование АД (СМАД). Оценка ПС, КЖ, СМАД проводилась на фоне предварительной отмены антигипертензивной терапии (более 3-5 сут.). Визиты должны были осуществляться в разные месяцы одного года, причем разность дневных температур окружающей среды между первым и вторым визитами должна была составлять 5 °С и больше. ПС оценивалось с использованием опросника СМОЛ (Сокращенный Многофакторный Опросник для исследования Личности, КЖ — опросника GWBQ (General Well-Being Questionnaire). Выраженность сезонного повышения артериального давление (ΔАД) при снижении окружающей температуры рассчитывалась как разность между показателями АД, которые фиксировались в более холодный сезон и уровнями АД, полученными в более теплый сезон (по результатам СМАД). Проводился многофакторный регрессионный анализ для оценки взаимодействия между выраженностью сезонных изменений АД и исходными гемодинамическими данными, социально-демографическими показателями, психологическими характеристиками, КЖ пациентов с АГ.
Результаты. В исследовании приняли участие 137 пациентов (77 (56 %) женщин и 60 (44 %) мужчин), средний возраст — 55,7 ± 0,8 лет, индекс массы тела (ИМТ) — 28,9 ± 0,4 кг/м2, длительность АГ — 11,9 ± 0,8 лет. У 70 пациентов оценен ПС, у 81 — КЖ. По результатам СМАД определены средние исходные амбулаторные показатели АД: дневные САД (САДд) — 144,7 ± 1,8 мм рт. ст., ночные САД (САДн) — 126,0 ± 1,2 мм рт. ст., дневные ДАД (ДАДд) — 91,6 ± 0,8 мм рт. ст., ДАД за ночь (ДАДн) — 75,1 ± 0,8 мм рт. ст. При проведении регрессионного анализа выявлено, что предикторами выраженности сезонного повышения АД были: 1) для САДд и для ДАДд — шкала 5 опросника КЖ (психологическая составляющая); 2) для ДАДн — диастолический эффект белого халата (ЭБХ). Определены несколько предикторов снижения АД в более холодный сезон: для ДАДд — это систолический ЭБХ и ИМТ.
Заключение. Основными гемодинамическими предикторами выраженности сезонных изменений АД стали уровни ЭБХ. Психологическая составляющая КЖ являлась предиктором повышения дневного САД и ДАД, а ИМТ — дневного снижения ДАД — в холодный сезон.
Цель. Охарактеризовать анемию при хронической сердечной недостаточности (ХСН) с сохраненной фракцией выброса левого желудочка (ХСНсФВ) и оценить эффективность применения препарата железа с гепсидин-независимым механизмом всасывания.
Материал и методы. В неконтролируемое исследование включили 30 пациентов с ХСНсФВ I-III функционального класса (ФК) по классификации Нью-Йоркской кардиологической ассоциации (NYHA) и анемией. Пациенты получали стандартную терапию ХСН в сочетании с препаратом сукросомального железа по 60 мг/сут. перорально в течение 3 мес. Ответ на терапию оценивали по показателям клинического анализа крови, обмена железа, маркерам воспаления, изменению функциональных тестов исходно и через 3 мес. после начала лечения.
Результаты. Анемия при ХСНсФВ соответствует анемии хронической болезни с повышенным содержанием гепсидина (219 (149-553) нг/мл) протекает с нарушением всасывания и метаболизма железа и развитием дефицита железа. Концентрация гемоглобина на фоне проводимой комплексной терапии увеличилась с 115 (98-117) г/л до 120 (103-133) г/л, p = 0,01, уровень эритроцитов повысился с 3,6 (3,5-4,1) × 1012/л до 4 (3,7-5,3) × 1012/л, p = 0,05, ферритина сыворотки — с 106 (40-181) мкг/л до 117 (83-166) мкг/л, p = 0,04. Выявлено снижение концентрации N-концевого натрийуретического про-пептида (NT-proBNP) с 374 (330-443) нг/мл до 236 (128-349) нг/мл, p = 0,004. После лечения отмечено повышение толерантности к физической нагрузке в виде снижения ФК по тесту 6-минутной ходьбы с 343,1 ± 100 м до 397 ± 73 м, p = 0,01, установлен прирост качества жизни, определяемый по шкале оценки клинического состояния (ШОКС), p = 0,01 и по Миннесотскому опроснику качества жизни у больных ХСН (MHFLQ), p = 0,002.
Заключение. Добавление перорального препарата железа с гепсидин- независимым механизмом действия к "стандартной" схеме лечения у пациентов с ХСНсФВ и анемией приводит к статистически значимому увеличению содержания гемоглобина, ферритина сыворотки, снижению NT-proBNP, повышению толерантности к физической нагрузке через 3 мес. после начала лечения, улучшению показателей качества жизни по ШОКС и MHFLQ в виде снижения баллов, уменьшению ФК ХСН по NYHA.
Цель. Проанализировать лекарственную терапию пациентов с неклапанной фибрилляцией предсердий (ФП) 80 лет и старше для выявления частоты ненадлежащего назначения лекарственных средств (ЛС) согласно критериям Бирса и оценить их роль в прогнозировании клинически значимого небольшого кровотечения (КЗНК) на фоне приема прямых оральных антикоагулянтов.
Материал и методы. Обследованы 367 пациентов с ФП 80 лет и старше (медиана (Ме) возраста — 84 (82; 88) года, 69,5% женщин). Проведено сравнение по частоте встречаемости ненадлежащего назначения ЛС между группами: пациенты с КЗНК (195 (53,1 %), Ме возраста — 84 (82; 87) года) и контрольная группа — без КЗНК (172 (46,9 %), Ме возраста — 84 (82; 88) года).
Результаты. Частота и среднее количество ненадлежащего назначения ЛС на одного пациента — 98,6 % и 3,8 ± 1,7 назначений соответственно. Пациенты с КЗНК в сравнении с пациентами без КЗНК имели более высокую частоту и среднее количество ненадлежащего назначения ЛС на одного пациента — 100 % vs 97,1 % (р = 0,022) и 4,6 ± 1,4 vs 2,9 ± 1,4 назначений (p < 0,001) соответственно. Каждое дополнительное ненадлежащее назначение ЛС ассоциировано с увеличением шансов наличия КЗНК в 2,66 (95 % ДИ 2,15; 3,38) раз (p < 0,001). Наличие ненадлежащего назначения ЛС ассоциировано с КЗНК (отношение шансов 12,8 (95 % ДИ 0,7; 234, p = 0,022).
Заключение. В работе показана высокая частота ненадлежащего назначения ЛС согласно критериям Бирса у пациентов с ФП 80 лет и старше. Выявлена значительная роль критериев Бирса в прогнозировании КЗНК на фоне приема прямых оральных антикоагулянтов.
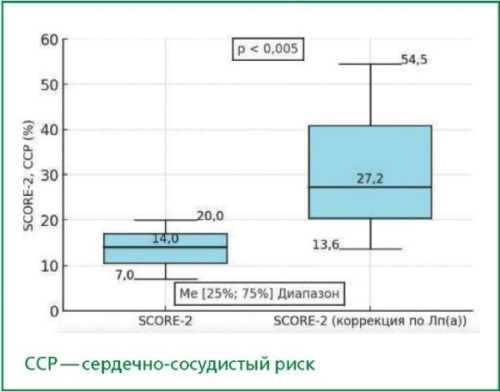
Цель. Оценить вклад экстремально повышенной концентрации липопротеида(а) (Лп(а)) в стратификацию сердечно-сосудистого риска по шкале SCORE-2 и вероятность диагноза семейной гиперхолестеринемии (СГХС).
Материал и методы. В ретроспективное исследование включены 45 пациентов (из них 25 мужчин) с гиперлипопротеидемией (а) из федерального регистра "РЕНЕССАНС". Участники исследования были старше 40 лет и имели уровень Лп(а) ≥180 мг/дл. Диагноз гетерозиготной СГХС подтвержден с использованием критериев сети голландских липидных клиник (Dutch Lipid Clinic Network, DLCN). Корректировка уровня холестерина липопротеидов низкой плотности (ХС ЛНП) выполнена по формуле Фридвальда в модификации Далена. Сердечно- сосудистый риск (по шкале SCORE2) рассчитывался с учётом уровня ХС ЛНП до и после проведённой коррекции.
Результаты. Среди 45 пациентов уровень ХС ЛНП, рассчитанный по формуле Фридвальда, составил 5,1 [3,17; 7,19] ммоль/л. После корректировки с использованием модификации Далена уровень ХС ЛНП составил 3,03 [1,54; 4,96] ммоль/л, т. е. оказался значительно ниже исходного (на 2,07 ммоль/л и на 40,6 %, p < 0,001). Пересчёт на основе скорректированных уровней ХС ЛНП повлиял на диагноз СГХС у 8 (26 %) из 31 пациентов. Корректировка значений риска по SCORE2 с учетом Лп(а) показала значительное увеличение величины сердечно- сосудистого риска. Исходная медиана значения SCORE2 составила 14 % [7; 20], а после корректировки увеличилась до 27,2 % [13,6; 54,5] — на 94 % (p < 0,005).
Заключение. Включение Лп(а) в рутинную оценку сердечно- сосудистого риска и диагностику СГХС является важным дополнением для более точной стратификации риска и назначения медикаментозного лечения. У пациентов с экстремальной гиперлипопротеидемией (а) уровень ХС ЛНП может быть завышенным в сравнении с истинным, что неизбежно повлияет на точность диагноза СГХС и стратегию лечения. Будущие многоцентровые исследования должны включать более крупные и разнообразные группы населения для подтверждения этих выводов.
СТРАНИЦЫ НАЦИОНАЛЬНОГО ОБЩЕСТВА ДОКАЗАТЕЛЬНОЙ ФАРМАКОТЕРАПИИ
Цель. В рамках регистра нерационального применения лекарственных препаратов (Chuvashia Inappropriate Prescribing Study, CHIP) у больных сердечно-сосудистыми заболеваниями оценить частоту и особенности самолечения (СМЛ).
Материал и методы. Исследование CHIP является одномоментным, в него последовательно включались пациенты > 50 лет, обратившиеся к кардиологу в консультативную поликлинику БУ "Республиканский кардиологический диспансер" Министерства здравоохранения Чувашской Республики. Критерии исключения: наличие психических, онкологических заболеваний, выявленных менее 5 лет назад, острой сердечно-сосудистой патологии в течение 6 мес. до обращения. Период включения пациентов — с 14. 12. 2023 по 07. 08. 2024. Врачом на приеме проводился осмотр, оценивалась лекарственная терапия, приверженность к ней, проводилась коррекция терапии в соответствии с действующими на момент исследования клиническими рекомендациями. Пациенты заполняли оригинальные опросники по оценке приверженности (шкала приверженности Национального общества доказательной фармакотерапии) и особенностей фармакотерапии. В настоящей работе описывается протокол исследования и анализируются данные, касающиеся СМЛ.
Результаты. В исследование включены 300 пациентов (120 мужчин и 180 женщин), у 120 (40 %) из них выявлен факт СМЛ. В число самостоятельно принимаемых больными лекарственных препаратов (ЛП) вошло 140 наименований. Поскольку часть пациентов принимала более 1 препарата, выявлено 164 случая СМЛ. При этом выделены следующие типы СМЛ: самоназначение не показанного препарата (38,4 %), самоназначение противопоказанного препарата (0,6 %), самоназначение показанного препарата, но не назначенного врачом (2,4 %), дублирование препаратов, относящихся к одному классу (3,6 %), замена назначенного препарата аналогом (5,5 %), оправданное СМЛ (использование как безрецептурных, так и рецептурных препаратов, 23,2 %), самостоятельное симптоматическое применение безрецептурных препаратов, не относящееся к оправданному — 26,3 %). При оценке результатов СМЛ выявлено 7 (4,3 %) случаев, когда оно приводило к созданию потенциально опасной комбинации ЛП. При дублировании ЛП в 2 (1,2 %) случаях их комбинация была нерациональной. Замена препарата в 4 (2,4 %) случаях считалась неэквивалентной. Статистически значимых различий между пациентами групп с выявленным СМЛ и без него не было, за исключением перенесённого острого нарушения мозгового кровообращения в анамнезе: среди таких пациентов значимо меньше тех, кто принимал лекарства самостоятельно.
Заключение. В регистре CHIP 40 % больных, наблюдающихся у врача по поводу сердечно-сосудистых заболеваний, самостоятельно принимали ЛП (как безрецептурные, так и рецептурные) вместе или вместо назначенной лечащими врачами терапии. Самоназначение непоказанного препарата — самый частый вид СМЛ у пациентов регистра CHIP (38,4 %). В 4 % случаев последствием СМЛ были потенциально опасные лекарственные комбинации.
Зарубежный опыт по внедрению в клиническую практику специальных программ, помогающих медицинским работникам реализовывать на практике доказательно обоснованное, отражённое в клинических рекомендациях (КР) лечение, подтверждает эффективность и успешность данной тактики — значимое устойчивое повышение качества медицинской помощи, улучшение результатов лечения, снижения количества неблагоприятных исходов. Неотъемлемой частью таких программ являются специальные инструменты (индексы, перечни критериев, шкалы), позволяющие оценить качество назначенного лечения, в том числе фармакотерапии, проконтролировать соответствие этого лечения положениям КР. С 2018 г. в Российской Федерации за КР законодательно закреплена роль нормативных документов, согласно которым должна оказываться медицинская помощь населению нашей страны. С января 2025 г. завершён поэтапный переход к обязательному соблюдению положений КР при оказании медицинской помощи всех уровней. Учитывая, что наиболее распространённым видом медицинского вмешательства является фармакотерапия, возрастает потребность в разработке и применении индикаторов её качества, определяющих в том числе соответствие назначенного лекарственного лечения указанному в КР, и необходимость внедрения таких индикаторов в медицинскую практику. В статье рассматриваются разработанные и апробированные к настоящему времени зарубежные и отечественные инструменты контроля качества фармакотерапии. Применение этих индексов в качестве самостоятельных инструментов для систем контроля качества или в составе комплексных электронных программ помощи принятия врачебных решений и самопроверки лечащими врачами лекарственных назначений представляется весьма перспективным направлением в сфере здравоохранения и требует дальнейшего изучения, развития и внедрения в медицинскую практику.
АКТУАЛЬНЫЕ ВОПРОСЫ КЛИНИЧЕСКОЙ ФАРМАКОЛОГИИ
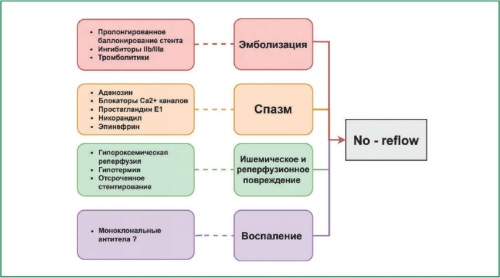
Феномен no-reflow остаётся серьёзным препятствием в лечении инфаркта миокарда, несмотря на прогресс в реперфузионной терапии, включая широкое применение первичного чрескожного коронарного вмешательства. Это явление, характеризующееся недостаточной микроциркуляцией после восстановления коронарного кровотока, значительно ухудшает клинические исходы, повышая риск сердечной недостаточности и смерти. С развитием методов диагностики, таких как магнитно-резонансная томография и динамическая сцинтиграфия миокарда, стала возможной более точная оценка микроциркуляторных изменений, позволяющая лучше понять механизмы no-reflow и целенаправленно подойти к его профилактике. Профилактические стратегии включают использование пролонгированного баллонирования стента, антитромботических препаратов (ингибиторов IIb/IIIa и внутрикоронарного тромболизиса), а также никорандила, который благодаря своим вазодилатирующим и цитопротективным свойствам демонстрирует обнадеживающие результаты в улучшении ангиографических и суррогатных маркеров реперфузии. Лечение уже развившегося no-reflow остаётся сложной задачей, так как текущие методы улучшают лишь суррогатные маркеры (TIMI и сегмент ST) без влияния на долгосрочные клинические исходы. Приоритетными средствами для лечения рефрактерного no-reflow являются никорандил и эпинефрин, особенно второй, который благодаря мощному коронаролитическому действию показал хорошие результаты в виде улучшения коронарного кровотока и снижения объёма микроваскулярной обструкции. Перспективные направления исследований включают использование моноклональных антител, способных избирательно блокировать ключевые воспалительные пути, а также гипероксемическую реперфузию. Однако требуется проведение дополнительных клинических исследований для подтверждения эффективности и безопасности данных подходов. Таким образом, поиск оптимальных терапевтических решений для управления no-reflow является важной задачей, требующей дальнейшего изучения для улучшения исходов у пациентов с инфарктом миокарда.
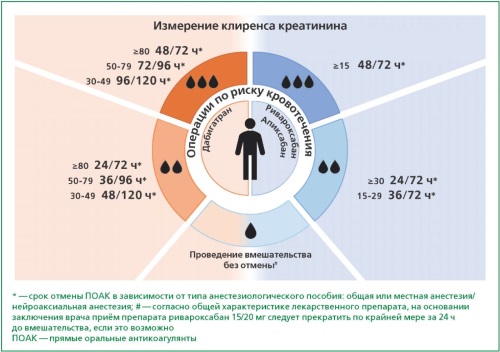
Статья посвящена периоперационному ведению пациентов с неклапанной фибрилляцией предсердий, получающих прямые оральные антикоагулянты при проведении плановых хирургических вмешательств или инвазивных процедур. Рассматриваются ключевые факторы, влияющие на тактику отмены и возобновления антикоагулянтной терапии, включая классификацию хирургических вмешательств по степени риска кровотечения, вид анестезии, клиренс креатинина и фармакокинетические свойства конкретного прямого орального антикоагулянта. Представлен унифицированный алгоритм, позволяющий определить оптимальные сроки отмены и возобновления приёма антикоагулянтов. Подробно анализируются возможные клинические сценарии, такие как эндоскопическая холецистэктомия, экстракция зубов, радикальная простатэктомия и эндопротезирование коленного сустава. Для каждого из этих случаев предлагаются практические рекомендации по периоперационному ведению, учитывающие индивидуальные особенности пациентов, риск тромбоэмболических и геморрагических осложнений, а также необходимость профилактики венозных тромбоэмболических осложнений. Отдельное внимание уделяется проблемам реальной клинической практики, таким как несогласованность действий между специалистами, различия в интерпретации рекомендаций и отсутствие единых внутрибольничных алгоритмов. Подчеркивается важность мультидисциплинарного подхода, обеспечивающего сбалансированное принятие решений. Обозначена необходимость применения индивидуального подхода при принятии решения об отмене и возобновлении антикоагулянтной терапии, а также важность стандартизированных протоколов для повышения безопасности пациентов с фибрилляцией предсердий. Рекомендуется учитывать фармакокинетические характеристики препаратов, особенности пациента и запланированного вмешательства, а также возможные риски. Использование чётких алгоритмов и активное мультидисциплинарное сотрудничество между клиницистами помогут минимизировать частоту как тромбоэмболических, так и геморрагических осложнений в периоперационном периоде.
КЛИНИЧЕСКИЙ СЛУЧАЙ
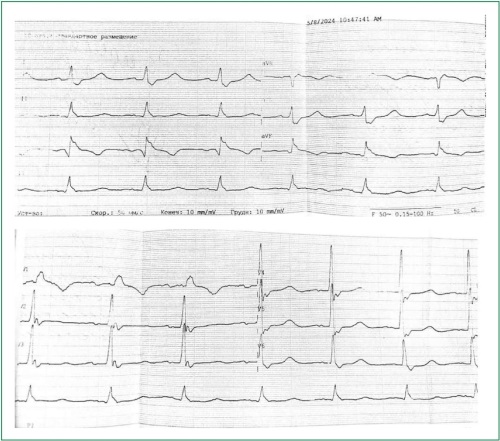
Описан клинический случай развития инфаркта миокарда (ИМ) нижней стенки левого желудочка (ЛЖ) с формированием зубца Q электрокардиограммы у 71-летнего пациента с ИМ в анамнезе, хроническими окклюзиями правой и огибающей коронарных артерий (КА), протяжённым сужением интермедиарной ветви в верхнем и среднем сегментах от 50 до 80 % и стенозом передней межжелудочковой артерии в верхнем сегменте 99 %. При поступлении в стационар на электрокардиограмме пациента на фоне синусового ритма регистрировалась полная блокада правой ножки пучка Гиса и подъём сегмента ST в III отведении до 0,5 мм. Диагноз ИМ подтверждён диагностически значимым уровнем высокочувствительного тропонина I. Отказ от попыток стентирования хронических окклюзий правой и огибающей КА, а также стентирование проксимального отдела передней межжелудочковой артерии привели к купированию боли за грудиной, стабилизации состояния пациента и последующей выписке его из стационара. При эхокардиографии при выписке выявлены акинезия и небольшое выбухание верхней половины нижней стенки ЛЖ, выраженная гипокинезия верхней и средней третей задней стенки ЛЖ, верхней трети нижнеперегородочной стенки ЛЖ. Фракция выброса ЛЖ по Симпсону — 44-45 %. Клинический случай демонстрирует важность верной тактики ведения пациентов с дистантным ИМ, когда правильный выбор инфаркт-связанной КА и ее стентирование привели к благоприятному исходу у пациента пожилого возраста с тяжёлым многососудистым поражением КА и развившимся повторным Q-образующим нижним дистантным ИМ.
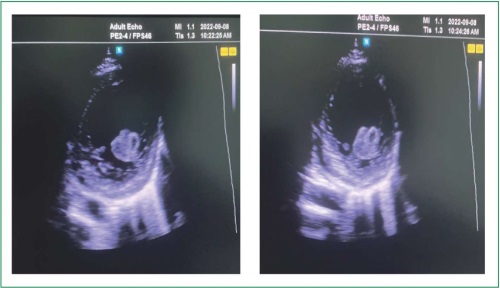
Миокардиальное повреждение при новой коронавирусной инфекции (COronaVIrus Disease 2019, COVID-19) преимущественно возникает у мужчин молодого возраста и сопряжено с тяжёлым течением, сомнительным прогнозом и высокой госпитальной летальностью, особенно в сочетании с повышением уровня тропонина и мозгового натрийуретического пептида. Кардиоваскулярные проявления могут возникать как в острый период заболевания, так и отсрочено, иметь краткосрочные (кардиогенный шок, тахиаритмия, острая сердечная недостаточность) и долгосрочные последствия (трансформация в дилатационную кардиомиопатию, хроническая сердечная недостаточность), предопределяя неблагоприятный исход. Представлено клиническое наблюдение пациента молодого возраста, госпитализированного в отделение реанимации и интенсивной терапии в связи с впервые развившейся острой левожелудочковой недостаточностью в виде отека лёгких на фоне тяжёлого течения COVID-19. В ходе обследования выявлено повышение маркеров миокардиального повреждения, дилатация всех камер сердца, снижение фракции выброса левого желудочка (ЛЖ) до 30 %, что свидетельствовало о миокардиальной дисфункции, а увеличение концентраций провоспалительных маркеров доказывало её воспалительный генез. Значительно повышенный уровень N-концевого фрагмента натрийуретического гормона и клинические признаки отека легких свидетельствовали об острой левожелудочковой недостаточности Killip III. Установлен заключительный клинический диагноз: острая воспалительная кардиомиопатия, осложнённая острой сердечной недостаточностью Killip III, тромб в полости ЛЖ на фоне COVID-19, внебольничной двухсторонней полисегментарной пневмонии, дыхательная недостаточность 3 ст. Вследствие своевременно начатой патогенетической терапии состояние пациента удалось стабилизировать и, несмотря на потенциально неблагоприятный прогноз, избежать летального исхода. Мониторинг клинического состояния пациента в течение 3 мес. после выписки выявил положительную динамику в виде рассасывания тромба в полости сердца, исчезновения признаков воспаления, незначительное увеличение фракции выброса ЛЖ, что позволяет думать о постепенном регрессе миокардиального повреждения.
ИНФОРМАЦИЯ
ISSN 2225-3653 (Online)